<목차>
9-1. 강산과 강염기
9-2. 약산과 약염기
9-3. 약산의 평형
9-4. 약염기의 평형
9-5. 완충 용액
9-5. 완충 용액 (2)
실험 9-1. 완충 용액의 작용
실제 완충 용액의 제조
0.100 M 트리스가 든 pH 7.60의 완충 용액 1.00 L를 만든다고 가정
고체 트리스 염화수소와 약 1 M NaOH가 주어진다면 다음과 같이 만듬
1) 트리스 염화수소 0.100 mol을 달아서 약 800 mL의 물이 담긴 비커에 녹임
2) 보정된 pH 전극을 용액에 담가 pH를 관찰
3) pH가 정확히 7.60이 될 때까지 NaOH를 첨가
4) 용액을 부피 플라스크에 옮기고, 비커를 몇번 씻음. 씻은 액을 부피 플라스크에 합함
5) 표선까지 묽히고 섞음
- 계산된 NaOH를 그대로 첨가하지 않는 이유
: 원하는 pH를 얻을 수 없기 때문
- 첫 번째 단계에서 물 800 mL를 쓰는 까닭
: pH를 조절하는 동안 부피가 최종 부피에 가까워질 것이기 때문
(그렇지 않으면 최종 부피로 묽혔을 때 pH가 약간 변할 것이고, 이온 세기도 변함)
완충 용량(buffer capacity, β)
: 강산 또는 강염기가 첨가될 때 용액이 얼마나 pH 변화를 막는지에 대한 척도

- Ca, Cb: 첨가한 강산 또는 강염기의 완충 용액에서의 농도
- β 값이 클수록 용액은 pH 변화에 더 잘 견딤

- (a) pKa= 5.00인 HA가 0.100 F만큼 들어있는 용액에 대하여 Cb와 pH의 관계를 보여주는 그래프
- 세로 축(Cb)는 해당되는 pH를 얻기 위해 0.100 F HA와 섞어주어야 할 강염기의 포말 농도
- (b) 같은 계에 대한 완충 용량을 보여준 그래프
- 완충 용량은 pH=pKa 일 때 최댓점에 도달 (pH 변화를 막는 데 가장 효과적)
- 완충 용액을 고를 대, 원하는 pH에 가능한 한 가장 가까운 pKa값을 갖는 완충제를 택해야 함
- 완충 용액의 유용한 pH 범위는 대체로 pKa±1임
- 완충 용액의 농도를 증가시키면 완충 용량도 증가
- pH가 높은 용액은 짝산-짝염기 쌍인 H2O/OH-에 의해서, pH가 낮은 용액은 짝산-짝염기 쌍인 H3O+/H2O에 의해 완충됨
완충 용액을 얼마나 사용해야 하나?
- 화학 반응이나 다른 시약의 첨가로 인해 생성되는 산이나 염기의 몰수보다 충분히 많은 몰수의 완충 용액이 있으면, pH는 크게 변하지 않음
p. 228 예제 <pH 변화량>
Q. 완충 용액에 완충제 HA 50 mmol과 완충제 A- 50 mmol이 들어 있다고 하자. pH는 HA의 pKa와 같을 것이다. 이 완충 용액 안에서 화학 반응으로 어떤 산 20 mmol이 생성되었다면, pH는 얼마나 변하겠는가?
- 가장 심하게 변하는 경우는 반응에 의해 강산이 생성되어 같은 당량의 A-를 HA로 만드는 것임
- HA의 몰수는 50+20=70 mmol임
- A-의 몰수는 50-20=30 mmol임

- pH는 0.37 단위 낮아짐. 이 변화를 받아들일 만하다면, 완충 용액이 충분한 것
p. 228 자습 <pH 변화량>
Q. 15 mmol의 강염기가 생성된 경우에는 원래 완충 용액의 pH가 얼마나 변하겠는가?
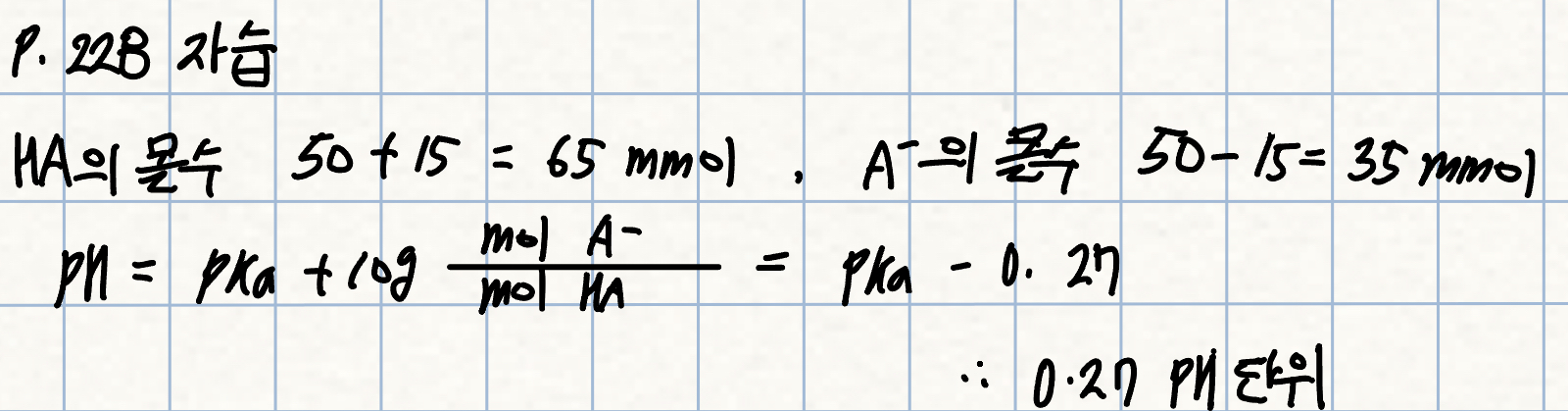
완충 용액은 이온 세기와 온도에 의존한다
- 정확한 Henderson-Hasselbalch 식은 활동도 계수가 포함됨
- 완충 용액의 실제 pH가 계산 값과 다른 주 원인은 이온 세기가 0이 아니어서 활동도 계수가 1이 아니기 때문
- 완충 용액의 이온 세기가 0보다 0.1 M에 가까울 경우, 보다 실질적인 계산을 위해 µ=0.1M에서의 pKa 값을 쓰는 것이 적절
- 붕산은 금속 이온처럼 작용하는 약산으로, 산 가수 분해 반응으로 인해 산성을 나타냄

- 0.200 mol B(OH)3와0.100 mol NaOH를 넣은 1.00 L의 수용액을 만들면, 이온 세기가 0.10 M인 붕산과 짝염기의 비가 대략 1:1인 혼합물이 생성됨
- 붕산과 붕산염의 1:1 혼합물은 이온 세기가 낮을 때는 pH가 9.24 근처이고, 이온 세기가 0.1 M일 때는 pH가 8.98 근처일 것임
- 완충 용액은 온도에도 의존
ex) 트리스는 실온 근처에서 온도가 1 ℃ 변함에 따라 약 -0.028 pKa 단위가 변할 만큼 온도 의존도가 큼
- 25℃에서 pH 8.07로 맞춘 트리스 용액은 4℃에서 대략 pH 8.7이고, 37℃에서 대략 pH 7.7이 됨
섞은 것과 용액 내의 실제 농도가 다를 때
- 묽은 용액이나 극단적 pH에서는 용액의 HA와 A-의 농도는 포말 농도와 다름
ex) FHA mol의 HA와 FA- mol의 염 NA+A-를 섞는다고 가정

- [NA+]=FA-를 전하 균형에 대입하고 정리

- 지금까지는 [HA] ≈ FHA, [A-] ≈ FA- 라고 가정해왔으나, 좀 더 엄밀하려면 위 값을 써야함
- 만일 FHA나 FA-가 작거나 [H+]나 [OH-]가 크다면, 근사는 좋지 않음
- 산성 용액에서는 [H+]>>[OH-]이고, 따라서 식에서 [OH-]는 무시 가능
- 염기성 용액에서는 [H+] 무시 가능
p. 231 예제 <비교적 강산으로 만든 묽은 완충 용액>
Q. 0.010 0 mol의 HA(pKa=2.00)와 0.010 0 mol의 A-를 녹여 1.00 L로 만든 용액의 pH는 얼마인가?
-- 용액은 산성일 것이므로, 식의 [OH-]항 무시 가능

- pH는 2.00이 아니고 2.38임. HA와 A-의 농도는 섞어 준 농도와 다름

- HA가 너무 강산이고 농도가 너무 낮으므로, HA와 A-의 농도가 그들의 포말 농도와 같지 않음
p.231 자습 <비교적 강산으로 만든 묽은 완충 용액>

완충 용액 정리
- 완충 용액은 약산과 그 짝염기로 구성
- 완충 용액은 pH ≈ pKa일 때 가장 유용
- 상당한 농도 범위에서 완충 용액의 pH는 농도와 거의 무관
- 완충 용액은 가해지는 산이나 염기와 반응하기 때문에 pH 변화를 막음
- 너무 많은 산이나 염기가 가해지면 완충제가 모두 소모되어 pH 변화를 더 이상 막지 못함
Keyword: 완충 용량(buffer capacity, β)



