목차
10-1. 이양성자성 산과 염기
10-2. 이양성자성 산의 완충 용액
10-3. 다양성자성 산과 염기
10-4. 어느 것이 주 화학종인가?
10-5. 분율 조성식
10-6. 등전 pH와 등이온 pH
10-1. 이양성자성 산과 염기 (2)
중간 형태(HL)
- 루신(HL)은 산이기도 하고 염기이기도 하므로, HL로 만들어진 용액은 H2L+나 L-로부터 만들어진 용액보다 더 복잡

- 양쪽성 양성자성(amphiprotic)
: 양성자를 내놓기도 하고 얻기도 하는 분자
- 산의 해리 반응은 염기의 수화 반응보다 더 큰 평형 상수를 가지므로, 루신 용액은 산성일 것으로 예측됨
- 그러나 Ka와 Kb의 크기가 여러 자리수의 차이가 나더라도, Kb 반응을 단순히 무시할 수 없음
- Ka반응에서 생성된 H+가 Kb반응에서 생성된 OH-와 반응하여 Kb반응을 오른쪽으로 가게 하기 때문에 두 반응은 거의 같은 정도로 진행됨
→ 평형의 체계적 처리법을 따라야 함
- 이 방법을 알짜 전하가 없는 중간 형태인 HL에 적용
- 이 결과는 전하에 관계없이 어떠한 이양성자성 산의 중간 형탵에도 잘 적용됨
- 반응 10-8과 10-9의 전하 균형

- 산 해리 평형으로부터 다음과 같이 치환 가능




- 이것들을 전하 균형에 대입
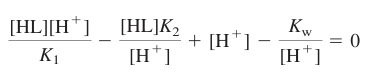
- 이 식은 H+에 대하여 풀 수 있음

- 다시 재배열

- 분자와 분모에 K1을 곱하고 양변에 제곱근 취하기

- 이 식은 활동도 계수를 무시한 것 이외에 다른 근사는 쓰지 않음
- [HL}은 약산이기도 하고 약염기이기도 하기 때문에, 주 화학종은 HL일 것
- 반응 10-8이나 10-9 어느 것이든 많이 진행되지 않으므로, 위 식의 [HL]에 단순히 0.050 0 M을 대입 가능
이양성자성 산의 중간 형태

- 여기서 F는 HL의 포말 농도임
- 위의 HL에 대한 식은 모든 이양성자성 산의 중간 형태에 적용됨
(이양성자성 산이 H2L+ 가 아니고 H2A일 때도 적용가능하다는 뜻)
Q. 0.050 0 M 루신 용액의 pH?

- 평형 식으로부터 다음의 농도도 계산 가능

- [HL] ≈ 0.050 0 M이라고 놓은 근사는 적절함
-[H2L+](=9.36 x 10-6 M)와 [L-](=1.02 x 10-5 M)는 0.050 0 M에 비하면 아주 작기 때문
→ 루신이 거의 전부가 HL 형태로 남음
- 다음과 같이 정리 가능

- 만약, [H2L+] + [L-]가 [HL]보다 그다지 적지 않거나, [H2L+]와 [L-] 값을 더 자세히 알고자 원하면, 연속 근사법을 사용할 수 음
보충 10-2
연속 근사법(successive approximation)
중간 형태에 대하여 단순화시킨 계산

- 위 식을 단순화시킬 수 있음
- 만일 K2F>>Kw이면, 식의 분자의 둘째 항은 버릴 수 있음

- 만일 K1<<F이면, 부놈에 있는 첫째 항도 버릴 수 있음

- 따라서, 다음과 같은 식이 됨

이양성자성 산의 중간 형태

- 즉, 이양성자성 산의 중간 형태의 pH는 대충 두 pKa값의 중간이고, 농도와는 거의 무관함
- 이양성자성 산의 중간 형태의 pH는 포말 농도와 거의 무관하게 pK1과 pK2의 중간 형태라는 것
p. 246 예제 <이양성자성 산의 중간 형태의 pH>
Q. 프탈산 수소 포타슘(potassium hydrogen phthalate, KHP)은 프탈산의 중간 형태의 염이다. 0.10 M과 0.010 M KHP 용액의 pH를 계산하시오.

- 프탈산 수소 포타슘의 pH는 농도에 관계없이 근사 식을 쓰면

- 기존 식을 이용하면,
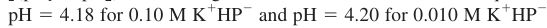
p. 246 자습 <이양성자성 산의 중간 형태의 pH>
Q. 식 10-11을 이용하여 0.002 M K+HP-의 pH를 구하시오.

이양성자성 산 계산법의 요약
1) H2A 용액
- H2L+를 Ka= K1인 일양성자성 산으로 취급. 다음 식으로부터[H+], [HA-], [H2A]를 얻음

- K2 평형 이용하면 [A2-] 계산 가능

2) HA- 용액
- 근사 [HA-] ≈ F를 사용, 식을 이용하여 pH를 구함

- 구한 pH는 다음과 같은 근사식에 가까워야 함

- 평형식을 이용하여 다음 값도 구할 수 있음

3) A2- 용액
- A2-를 Kb=Kb1=Kw/Ka2인 일염기성 염기로 취급하며, 다음 식으로부터 얻음

- K1 평형식을 이용하여 [H2A]에 대하여 품
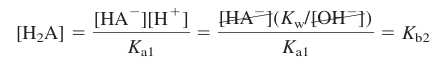
Keyword: 양쪽성 양성자성(amphiprotic), 이양성자성 산의 중간 형태, 근사치



