목차
10-1. 이양성자성 산과 염기
10-2. 이양성자성 산의 완충 용액
10-3. 다양성자성 산과 염기
10-4. 어느 것이 주 화학종인가?
10-5. 분율 조성식
10-6. 등전 pH와 등이온 pH
10-1. 이양성자성 산과 염기 (1)
다양성자성 산과 염기(polyprotic acid and base)
: 두 개 이상의 양성자를 주거나 받을 수 있는 것들
이양성자성(diprotic)
: 두 개의 산성 또는 염기성 자리를 갖는 것
- 주어진 pH에서 우세한 화학종이 어떤 것인지 생각해볼 것
이양성자성 산과 염기
아미노산(amino acid)
: 단백질의 구성 단위로, 산성의 카복실기와 염기성의 아미노기, 그리고 R로 표시되는 여러 치환기 갖고 있음
- 카복실기가 암모늄기보다 산성이 강하므로, 비이온성 형태는 자발적으로 양전하와 음전하를 모두 갖는 쯔비터 이온(zwitterion)으로 바뀜
쯔비터 이온(zwitterion)
: 양전하와 음전하를 함께 가진 중성 분자
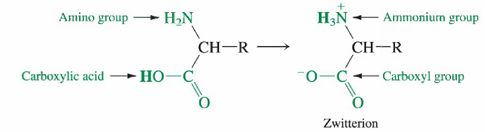
- 낮은 pH에서는 암모늄기와 카복실기 둘 다 양성자화됨
- pH가 높으면 둘 다 양성자화되지 못함
- 수용액에서 쯔비터 이온은 -NH3+와 -CO2-가 각각 물과 상호 작용하여 안정화
- 고체상에서 인접 분자 간에 -NH3+로부터 -CO2-로 수소 결합 이뤄 안정화
- 기체 상에서는 전하를 안정화시키는 이웃 분자가 없으므로 -NH2에서 카보닐 산소로 분자내(intramolecular_ 수소 결합을 이루는 비이온성 구조 우세

루신(Lucine, HL로 표기)의 평형상수

이양성자성 산과 이양성자성 염기

Ka와 Kb의 관계

p. 239 예제 <부록 G의 아미노산 구조 해석>
Q. 부록 G의 화학 구조는 완전히 양성자화된 형태로 그려져 있다. 각 화합물의 이름은 알짜 전하가 없는 중성 분자를 지칭한다. 루신은 다음과 같이 그려져 있는데
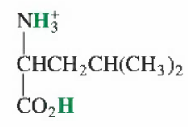
- 이는 중성 루신이 아니다. 이 구조는 +1의 전하를 갖고 있음
- 이 구조는 H2L+로 표기할 수 있음
- H2L+의 화학은 여느 이양성자성 산 H2A와 마찬가지임
- 부록 G의 Ka 값들은 2.328 (CO2H), 9.744 (NH3)임
- 큰 Ka=10-2.328은 카복시 양성자에 대한 것으로, 하나의 양성자가 떨어져 나가면 다음의 구조를 가짐

- 이것이 루신으로 전하가 0임
- 이 구조는 HL로 표기 가능. L은 루신을 의미
- HL의 화학은 여느 이양성자성 산의 중간 형태 HA-와 마찬가지임
- 작은 Ka=10-9.744는 암모늄 양성자에 대한 것으로, 두 번째 양성자가 떨어져 나가면 다음의 구조를 가짐

- 이 구조는 L-로 표기 가능
- L-의 화학은 여느 이양성자성 산의 완전히 염기성 형태인 A2-와 마찬가지임
p. 240 자습 <부록 G의 아미노산 구조 해석>
Q. 부록 G의 트레오닌은 이양성자성 아미노산이다. 트레오닌의 세 가지 형태를 그리시오. 또 그들을 H2T+, HT, T-로 표기하시오. 이양성자성 산의 H2A, HA-, A2-와 연관지으시오. 어느 구조가 트레오닌인가?

- 가운데 구조가 트레오닌
0.050 0 M H2L+, 0.050 0 M HL, 0.050 0 M L- 각 용액의 pH와 조성을 계산해보자.
- 여기서 택하는 방법은 산이나 염기의 전하와 관계 없음
- 즉, 이양성자성 산 H2A 또는 H2L+의 pH를 구하는 데 같은 절차를 따름
- A는 무엇이든지 좋으며, HL은 루신임
산성 형태(H2L+)
- 루신의 염화수소는 양성자화된 H2L+를 갖고 있어 두 단계로 해리 될 수 있음
- H2L+는 K1=4.70 x 10-3이므로 약산
- HL은 K2=1.80 x 10-10이므로 더 약산
- H2L+는 부분적으로 해리할 것이며, 그래서 생긴 HL은 거의 해리하지 않을 것
- 이 때문에, H2L+용액은 마치 Ka = K1인 일양성자성 산처럼 거동한다고 근사 가능
- 이 근사를 택하면 0.050 0 M H2L+용액의 pH를 계산하는 것은 쉬움
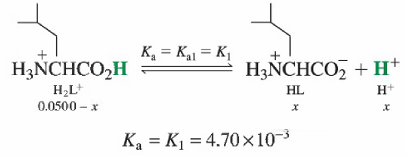




- Q. 이 용액에서 L-의 농도는 얼마인가?
- 그 농도가 매우 작다고 이미 가정했지만, 0은 아님
- 위에서 구한 HL과 H+의 농도 및 K2 식을 이용하면 [L-] 계산 가능


- [H+] ≈ [HL]이라고 근사하였으므로, [L-]=K2가 됨
- H2L+가 해리하는 것에 비하면 HL의 해리는 정말로 무시할 수 있음
- 만일 K2가 K1 보다 10배만 작다고 가정하더라도, 두 번째 이온화를 무시하고서 계산한 [H+]의 값은 오차가 4% 밖에 되지 않음
- 요약: 이양성자성 산의 용액은 Ka = K1 인 일양성자성 산의 용액처럼 거동함
염기성 형태(L-)
- 루신(HL)을 같은 몰수의 NaOH로 처리하면 얻을 수 있는 루신산 소듐(sodium leucinate)과 같은 염에 들어 있음
- 루신산 소듐을 물에 녹이면 완전히 염기성 성분인 L- 용액이 얻어짐
- 이 염기성 음이온에 대한 두 Kb 값은 다음과 같음

- Kb1 값은 L-가 HL을 만드는 가수 분해 반응이 거의 일어나지 않는다는 것을 말해줌
- Kb2의 값은 그렇게 해서 생기는 HL이 더욱 약한 염기이므로, H2L+를 만드는 반응도 거의 진행되지 않음
- L-를 Kb = Kb1인 일염기성 화학종으로 취급(근사)

- H2L+의 농도는 Kb2(또는 Ka1) 평형식으로부터 구할 수 있음


- [H2L+]는 [HL]에 비하여 중요하지 않다는 근사 확인 가능
- 요약 : Ka1과 Ka2 사이(Kb1과 Kb2 사이)의 크기 차이가 상당한 정도이면, 이양성자성 산의 완전한 염기성 형태의 용액은 Kb=Kb1인 일염기성 화학종처럼 취급 가능
Keyword: 다양성자성 산과 염기(polyprotic acid and base), 아미노산(amino acid), 쯔비터 이온(zwitterion), 이양성자성 산, 이양성자성 염기



