11-1. 강산에 의한 강염기의 적정
11-2. 강염기에 의한 약산의 적정
11-3. 강산에 의한 약염기의 적정
11-4. 이양성자성 계에서의 적정
11-5. pH 전극에 의한 종말점 검출
11-6. 지시약에 의한 종말점 검출
11-7. 실제적인 주의점
11-8. Kjeldahl 질소 분석법
11-9. 평준화 효과
11-10. 스프레드시트에 의한 적정 곡선의 계산
11-4. 이양성자성 계에서의 적정

- 일양성성 산과 염기의 적정에 대한 원리를 그대로 다양성자성 산과 염기의 적정에 응용
전형적인 경우
- 그림에서 위쪽 곡선은 0.100 M HCl로 0.100 M 염기(B) 10.0 mL를 적정하는 경우에 계산된 것
- 염기는 pKb1 = 4.00이고, pKb2 = 9.00인 이염기성
- 다음 반응에 해당하는 당량점부근에서 두 개의 뚜렷한 변곡점을 나타냄

- 제 1 당량점에서 적정 용액의 부피는 10.0 mL임
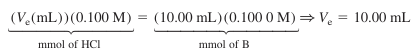
- 제 2 당량점에서는 두 번째 반응이 첫 번째 반응과 같은 몰수의 HCl이 사용되므로, 적정 용액의 부피는 2Ve가 되어야 함
점 A
- 산이 가해지기 전에는 용액에 약염기인 B만 존재하므로, pH는 다음 반응에 의해 진행됨
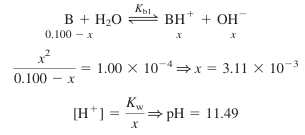
- 이염기성 화합물은 일염기성 화합물과 같이 생각할 수 있음
(즉, Kb2 반응은 무시할 수 있음)
점 B
- 점 A(초기점)와 C(제 1 당량점) 사이에서는 B와 BH+를 포함하는 완충 용액이 됨
- 점 B는 당량점으 절반에 해당되므로, [B] = [BH+]
- pH는 약산 BH+에 대한 Henderson-Hasselbalch 식을 사용하여 계산
- BH+의 산 해리 상수는 BH2 2+에 대한 Ka2임
- Ka2(BH2 2+에 대한) = Kw / Kb1 = 10^-10.00임
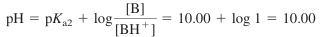
- 점 B에서의 pH 값은 pKa2가 됨
- 완충 용액 영역 내에 있는 어떤 점에서의 [B]/[BH+] 비를 계산한다는 것은 적정된 점 A와 C 사이의 분율을 구하는 것임
- Va = 1.5 mL일 때,

- 당량점에 이르기 위해서는 적정 용액이 10.0 mL 필요한데, 1.5 mL만 가해졌기 때문.
- 즉, Va = 1.5 mL일 때 pH는 다음과 같음
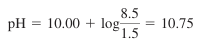
점 C
- 제1 당량점에서는 B가 이양성자성 산 BH2 2+의 중간형인 BH+로 전환됨
- BH+는 산인 동시에 염기임
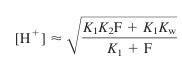
- K1과 K2는 BH2 2+의 산 해리 상수
- BH+의 포말 농도는 B 원액의 묽힘을 고려하여 계산

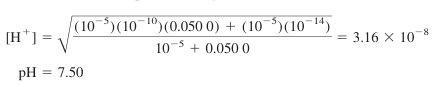
- 점 C는 적정 곡선 상에 놓여 있는 이양성자성 산의 중간형임
- 소량의 산 또는 염기를 첨가할 때 pH가 급혁히 변하므로, 가장 완충력이 낮은 지점
- 이양성자성 산의 중간형은 완충제로서는 가장 나쁜 선택임
점 D
- 점 C와 E 사이의 용액은 BH+(염기)와 BH2 2+(산)을 포함하는 완충 용액임
- Va = 15.0 mL일 때, [BH+] = [BH2 2+]이고 pH는 다음과 같음

점 E
- 제 2 당량점으로서, 이 용액은 실제로 물에 BH2Cl2를 녹인 것과 같음
- BH2 2+의 포말 농도는 다음과 같음
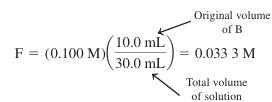
- 이 경우의 pH는 BH2 2+의 산 해리 상수에 의해 결정됨
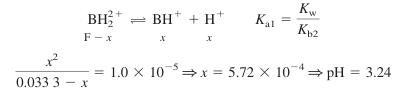
- 제 2 당량점 이상(Va > 20.0 mL)에서 용액의 pH는 가해진 강산의 부피로 계산 가능
- Va = 25.00 mL일 때 0.100 M HCl은 5.00 mL만큼 과량이며, 용액의 전체 부피는 10.00 + 25.00 = 35.00 mL임
- pH는 다음과 같음
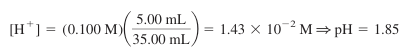
불분명한 종말점
- 대부분의 이양성자성 산이나 염기의 적정은 곡선 a와 같이 뚜렷한 종말점을 나타냄
- 몇 가지 적정에서는 곡선 b처럼 두 개의 종말점이 나타나지 않는 경우도 있음
- 곡선 b는 0.100 M HCl에 의한 0.100 M 니코틴(pKb1 = 6.15, pKb2 = 10.85) 10.0 mL의 적정에 대해 계싼한 것
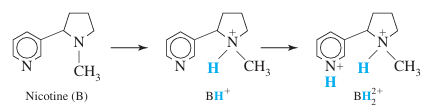
- BH2 2+가 너무 강한 산(또는 마찬가지로 BH+가 대단한 약염기)이기 때문에, 제 2 당량점(J)에서는 분명한 변곡점이 거의 나타나지 않음
- 적정이 낮은 pH(≤3)에 가까워 졌을 때 HCl이 모두 BH+와 반응하여 BH2 2+가 된다고 가정할 수 없음
- I점과 J점 사이의 pH 값을 계산하기 위해선 평형을 체계적으로 다루어야 함
→ 스프레드시트 이용하여 전체 곡선 계산하는 방법
Keyword: 이양성자성 계에서의 적정 과정



