<목차>
9-1. 강산과 강염기
9-2. 약산과 약염기
9-3. 약산의 평형
9-4. 약염기의 평형
9-5. 완충 용액
9-1. 강산과 강염기
Intro.
- 여러 분석 방법(크로마토그래피, 전기 이동 등)을
제대로 사용하는 데에 산-염기 필수적
- ex. 단백질의 생합성, 암석의 풍화
9-1. 강산과 강염기
Q. 0.10 M HBr 용액의 pH 계산
- HBr : 강산(strong acid)

p.212 예제 <강산 에서의 활동도 계수>
활동도 계수를 써서 0.10 M HBR 용액의 pH를
계산하시오.

p. 212 자습 <강산에서의 활동도 계수>
0.090 M KBr에 녹인 0.010 M HBr의 pH를
계산하시오

Q. 0.10 M KOH 용액의 pH 계산
- KOH : 강염기(strong base)

pH와 pOH의 관계

평형의 체계적 처리
(1) 적절한 반응식
(2) 전하 균형
(3) 질량 균형
(4) 평형 상수
(5) 센다
(6) 푼다
Q. 1.0 x 10-8 KOH 용액의 pH?

정리

- 곡선을 세 영역으로 나누어 생각
1. 농도가 진하면(≥10-6 M) pH는 가해준 H+나 OH- 농도 만으로 계산됨.
2. 농도가 묽으면(≤10-8 M) pH는 7.00임. 물 자체의 pH에 영향을 줄 만큼 산이나 염기가 가해지지 않음.
3. 중간 농도(10-6에서 10-8 M)면 물의 이온화에 의한 영향과 가해준 산이나 염기의 영향이 서로 견줄만 함.
→ 이 영역에서만 체계적 평형 계산이 필요.
물은 거의 대부분의 경우 10-7 M H+와 10-7 M OH-를 생성하지 않는다.
- 아무런 산이나 염기가 가해지지 않은
순수한 물에서만 해당되는 사실
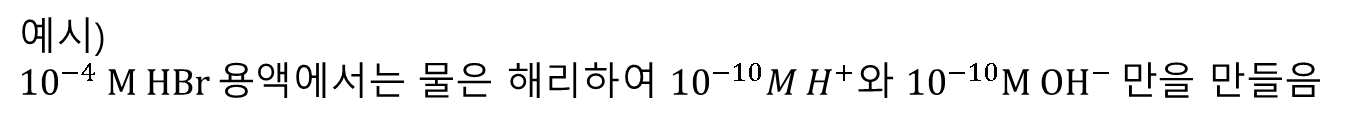
키워드: 강산(strong acid), 강염기(strong base),
평형의 체계적 처리



