<목차>
9-1. 강산과 강염기
9-2. 약산과 약염기
9-3. 약산의 평형
9-4. 약염기의 평형
9-5. 완충 용액
o-하이드록시벤조산(hydroxybenzoic acid)과 p-하이드록시벤조산의 이온화 비교
- o-하이드록시산이 p-하이드록시산에 비해 30배 이상 더 산성
- 오쏘(Ortho) 이성질체에허는 산 해리 반응의 생성물이 강한 분자 내 수소 결합을 만들 수 있음

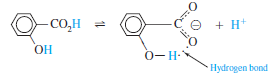
- 파라(para) 이성질체에서는 -OH기와 -CO2-기가 너무 멀리 떨어져 있어 분자 내 수소 결합을 이룰 수 없음
- 분자 내 수소결합이 생성물을 안정화시키므로 o-하이드록시벤조산이 더 산성
전형적인 약산 문제
포말(formal) 농도란?
- 1L에 녹은 어떤 화합물의 전체 몰수
- 약산의 포말 농도는 일부가 A-로 변한 것에 관계 없이 용액에 넣어 준 전체 HA의 양임
포말(formal) 농도란?
포말 농도 1L에 녹은 어떤 화합물의 전체 몰수. - 약산의 포말 농도는 일부가 A-로 변한 것에 관계없이 용액에 넣어 준 전체 HA의 양임
chemi-up.tistory.com
Q. 약산의 포말(formal) 농도와 Ka 값이 주어질 때, 약산 HA와 pH를 구하기

Q. o-하이드록시벤조산의 F=0.050 0M, Ka= 1.07 X 10-3일 때, pH 구하기

pH = 2.17
Q. HA로부터 주로 H+가 나온다는 가정은 적절한가? O

해리 분율
약산의 해리 분율(fraction of dissociation, α)

Q. 0.05 0 M o-하이드록시벤조산의 해리 분율?

- 즉, 포말 농도가 0.050 0 M일 때, 산의 14%가 해리함

- 포말 농도에 따른 α의 값의 변화
- 약전해질(weak electrolyte, 부분적으로만 해리하는 화합물)은 묽어짐에 따라 더 많이 해리함
- O-hydroxybenzoate가 p-hydroxybenzoate보다 더 많이 해리하는 것을 볼 수 있음
약산 문제의 본질
- 약산 문제에 접하면 즉시 [H+]=[A-]=x임을 인식
- 이는 산의 농도가 매우 묽거나(≤10-6 M), 산이 너무 약한 경우 [H^+]≈[A^- ]로 놓는 근사는 좋지 않음
(이런 경우는 실제 문제에서 잘 나타나지 않음)
p. 218 <약산 문제>
Q. 0.050 M 염화 트라이메틸암모늄 용액의 pH를 구하시오.

* Cl-는 강산 HCl의 짝염기이므로 산성이나 염기성이 없다
(만약 Cl-가 상당한 염기성을 가졌다면, HCl은 완전히 해리하지 않았을 것)
- 할로젠화 암모늄 염은 완전히 해리하여 (CH3)3NH+와 Cl-로 된다고 가정
- 트라이메틸암모늄 이온은 약염기인 트라이메틸 아민 (CH3)3N의 짝산이므로 약산임을 인식
- Cl-는 염기나 산의 성질을 갖지 않으므로 무시
- µ = 0에서 pKa=9.799 트라이메틸암모늄 이온
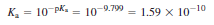
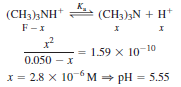
p. 218 자습 문제 <약산 문제>
Q. 0.050 M 브로민화 트라이에틸맘모늄의 pH를 구하시오

Keyword: 해리 분율(fraction of dissociation, α), 약전해질(weak electrolyte)



