11-1. 강산에 의한 강염기의 적정
11-2. 강염기에 의한 약산의 적정
11-3. 강산에 의한 약염기의 적정
11-4. 이양성자성 계에서의 적정
11-5. pH 전극에 의한 종말점 검출
11-6. 지시약에 의한 종말점 검출
11-7. 실제적인 주의점
11-8. Kjeldahl 질소 분석법
11-9. 평준화 효과
11-10. 스프레드시트에 의한 적정 곡선의 계산
11-1. 강산에 의한 강염기의 적정
RNA의 산-염기 적정
- 산-염기 적정 곡선으로부터 혼합물에 있는 산성 또는 염기성 물질의 양과 pKa 값 예측 가능
- 의화학 분야에서 어떠한 약물은 효과를 내려면 세포막을 통과해야할 필요가 있음
- 후보 약물 분자가 세포막을 통과하는지 예상하는 데 있어 분자가 지방 친화적(lipophilic)이거나 전하가 작을수록 세포에 더 잘 들어감
- 이번 단원, 적정 곡선의 모양 예상하고, 전극이나 지시약으로 종말점을 찾아내는지 알아볼 것
※ 지방 친화도
: 무극성 용매에서 용해도의 척도
- 약품이 물과 옥탄올에서 이루는 분배 평형으로부터 구할 수 있음

강산에 의한 강염기의 적정
- 적정 용액(titrant)이 가해질 때 pH변화를 나타내는 그래프 작성할 것
→ 적정 과정의 화학을 이해할 수 있고, 실험적인 적정 곡선 해석 가능
- pH는 보통 유리 전극으로 측정 (15-5절)
1> 적정 용액과 분석 물질 사이의 화학 반응식을 적는 것
2> 그 반응을 이용하여 적정 용액이 가해진 후 조성과 pH 계산
Q. 0.020 00 M KOH 50.00 mL를 0.100 0 M HBr로 적정하는 과정?
- 반응식

- 위 반응에 대한 평형 상수가 1014이므로, 반응은 완결됨
- 즉, 가해지는 H+는 즉시 화학량론적으로 대응되는 OH-와 반응함
- 편리한 방법: 먼저 당량점에 도달하는 데 필요한 HBr의 부피(Ve)를 계산하여, 적정될 KOH의 몰수와 첨가될 HBr의 몰수가 서로 같다는 식으로부터 얻을 수 있음

- L 대신 mL 단위로도 가능

- 이때, 10.00 mL의 HBr이 가해지면 적정이 완결됨
- 당량점에 도달하기 전에는 미반응된 과량의 OH-가 남아 있게 됨
- Ve점을 지나면 용액에는 과량의 H+가 있게 됨
- 일반적으로, 강염기를 강산으로 정정하는 경우, 적정 곡선에는 세 가지 영역이 나타남
1) 당량점에 도달하기 이전의 pH는 용액 속에 남아 있는 과량의 OH-에 의해 결정됨
2) 당량점에서는 H+의 양이 모든 OH-와 반응하여 H2O를 생성. 이때 pH는 물의 해리에 의해 결정됨
3) 당량점 이후의 pH는 용액 중에 있는 과량의 H+에 의해 결정됨
당량점(equivalence point)
: 가한 적정 용액이 분석 물질과 화학량론적 반응을 일으키는 데 필요한 정확한 양이 되는 때
- 적정에서 찾는 이상적인 결과
종말점(end point)
: 실제로 측정, 지시약의 색이나 전극 전위와 같은 것의 급격한 물리적 변화로 나타남
영역 1: 당량점 이전
- HBr 3.00 mL를 가했을 때 전체 부피는 53.00 mL가 됨
- HBr이 NaOH에 의해 소모되면 과량의 NaOH가 남게 됨
- 가해진 HBr의 몰수: (0.100 0 M)(0.003 00L) = 0.300 X 10^-3 mol HBr = 0.300 mmol NaOH
- NaOH의 초기 몰수는 (0.020 00 M)(0.050 00 L) = 1.000 x 10^-3 mol NaOH = 1.000 mmol NaOH
- 반응하지 않은 OH-는 1.000 mmol - 0.300 mmol = 0.700 mmol,
그 농도는 (0.700 mmol)/(53.00 mL) = 0.013 2 M


- 3.00 mL의 HBr이 가해지면, Ve = 10.00 mL이기 때문에, 반응은 3/10만큼 완결됨
- 용액 내에 남아 있는 미반응 OH-의 분율은 7/10임
- 플라스크의 OH-의 농도


- [OH-]가 초기 농도에 대한 미반응 분율을 묽힘 보정한 것과 같음
- 묽힘 인자: 분석 물질의 초기 부피를 용액 전체의 부피로 나눈 것

- pH 값은 그 유효 숫자와 관계없이 소수점 자리 0.01까지만 표시
→ 일관된 결과를 얻기 위해서뿐만 아니라, 0.01이 pH 측정 시 정확도의 한계와 근접하기 때문
p. 266 도전
Q. 6.00 mL의 HBr이 가해진 후의 [OH-]의 계산 값에 대응되는 pH 값을 표 11-1에서 확인하라

영역 2: 당량점에서
- 모든 OH-와 화학량론적으로 반응할 정도의 H+가 가해짐
- 물에 KBR을 녹이면 이와 같은 용액이 만들어짐. pH는 물의 해리에 의해 결정됨
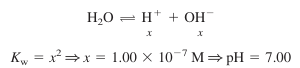
- 강염기(또는 강산)를 강산(또는 강염기)으로 적정하는 경우 당량점에서의 pH는 25℃에서 7.00임
- 약산 또는 약염기에 대한 적정의 경우는 당량점에서의 pH가 7.00이 아님에 주의
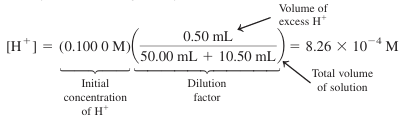
영역 3: 당량점 이후
- 용액에 과량의 HBr이 가해짐
- 10.50 mL가 가해졌을 때, Va - Ve = 10.50 - 10.00 = 0.50 mL에 해당하는 HBr을 과량으로 넣은 것
- 과량의 H+의 농도 식
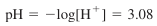
적정 곡선
- 당량점 근처에서 pH가 급변함
- 당량점은 기울기(dpH/dVa)가 최대인 점(이차 도함수는 0, 변곡점(inflection point)
- 강산-강염기 적정에서만 당량점에서의 pH 값이 7.00임
- 반응물들 중 하나 또는 둘 다 약산 또는 약염기라면 당량점에서의 pH는 7.00이 아님
Keyword: 당량점(equivalence point), 종말점(end point)



