해리스 분석화학 제 10판 본문 문제 풀이
11장. 산-염기 적정
1. 강산에 의한 강염기 적정 과정을 서술하시오.
0.020 00 M KOH 50.00 mL를 0.100 0 M HBr로 적정하는 과정이다.
(1) HBr 3.00 mL를 가했을 때
(2) HBr를 당량점 만큼 가했을 때
(3) HBr 10.50 mL를 가했을 때
풀이:

2. 다음 과정에 대하여 서술하시오.
0.020 00 M MES 50.00 mL를 0.100 0 M NaOH로 적정하는 적정 과정을 서술하시오.
참고: MES pKa = 6.27
(1) 당량점에 도달하는 데 필요한 염기의 부피 Vb?
(2) 영역이 몇 개로 나뉘는가?
(3) NaOH를 가하기 이전의 pH?
(4) 3.00 mL의 OH-가 가해졌을 때의 pH?
(5) NaOH를 당량점만큼 가했을 때의 pH?
(6) Vb = 10.10 mL일 때의 pH?
(7) 완충 용량(buffer capacity)에서의 특징?
풀이:

3. p.271 예제
0.106 7 M HCl로 0.083 64 M 피리딘 25.00 mL를 적정하는 경우를 살펴보자.
(참고: Kb = 1.59 X 10^-9)
Va = 4.63 mL일 때의 pH를 구하시오.
풀이:

4. p. 271 자습
Va = 14.63 mL일 때 pH?
풀이:

5. p.271 본문
0.100 M HCl로 0.100 M 염기(B) 10.0 mL를 적정하는 경우 적정 과정을 서술하시오.
(참고: pKb1 : 4.00, pKb2 : 9.00인 이염기성)
(1) 식, 적정 용액의 부피?
(2) 초기점의 pH?
(3) 초기점과 제 1 당량점사이의 pH? (Va = 1.5 mL일 때)
(4) 제 1 당량점에서의 pH?
(5) 제 1 당량점과 제 2 당량점 사이에서의 pH?(Va = 15.00 mL일 때)
(6) 제 2 당량점에서의 pH?
(7) 제 2 당량점 이상에서의 pH?(Va = 25.00 mL일 때(Va = 25.00 mL일 때)
풀이:

6. p.276 예제
그림 11-6에 있는 일차 및 이차 도함수를 계산하는 방법?
7. p.276 자습
그림 11-6의 D7 셀의 도함수를 증명하라.
풀이:
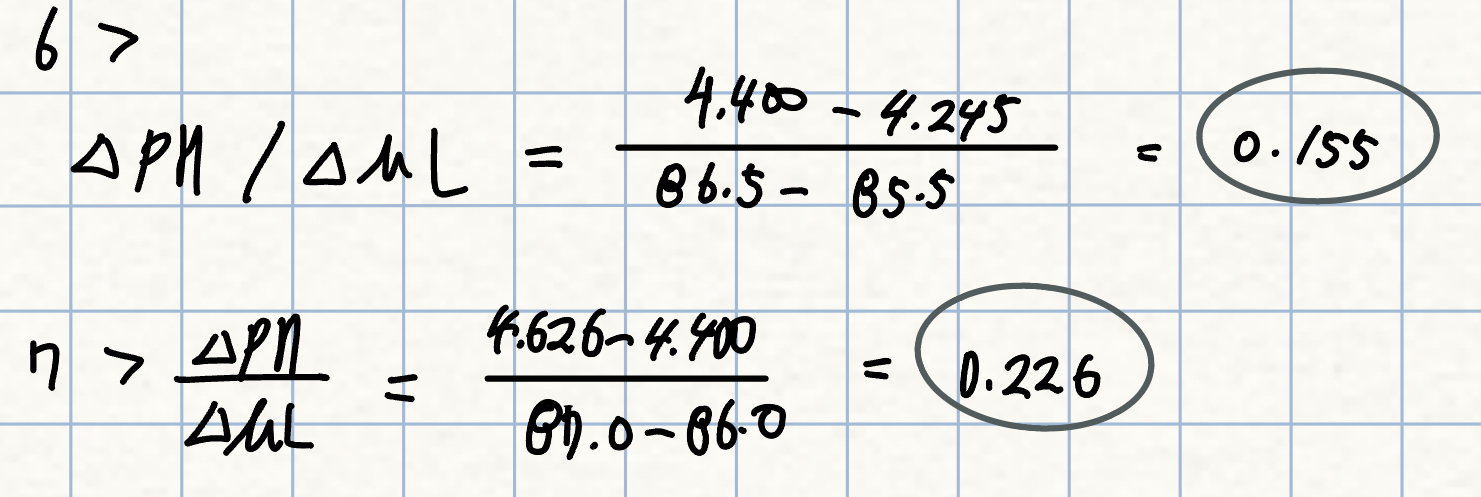
8. p.284 예제
전형적인 단백질은 16.2 wt%의 질소를 함유하고 있다. 단백질 용액 0.500 mL를 섞어서 유리시킨 NH3를 0.021 40 M HCl 10.00 mL 속으로 증류시킨다. 미반응 HCl을 적정하는데 0.019 8 M NaOH가 3.26 mL 필요하다. 원래 시료에 존재하는 단백질의 농도(mg 단백질/mL)를 구하시오.
풀이:

9> p. 285 자습
NaOH 3.00 mL가 소모되었을 때, mg 단백질/mL 단위로 단백질의 농도를 구하시오.
풀이:




