해리스 분석화학 제 10판 본문 문제 풀이
10장. 다양성자성 산-염기 평형
1. 이양성자성 산, 염기 반응식과 평형상수를 서술하고, Ka와 Kb의 관계는 어떠한지 작성하라.
풀이:

2. p. 239 예제
루신의 3가지 형태를 그리고, 이양성자성 산의 H2A, HA-, A2-와 연관지으시오.
풀이:

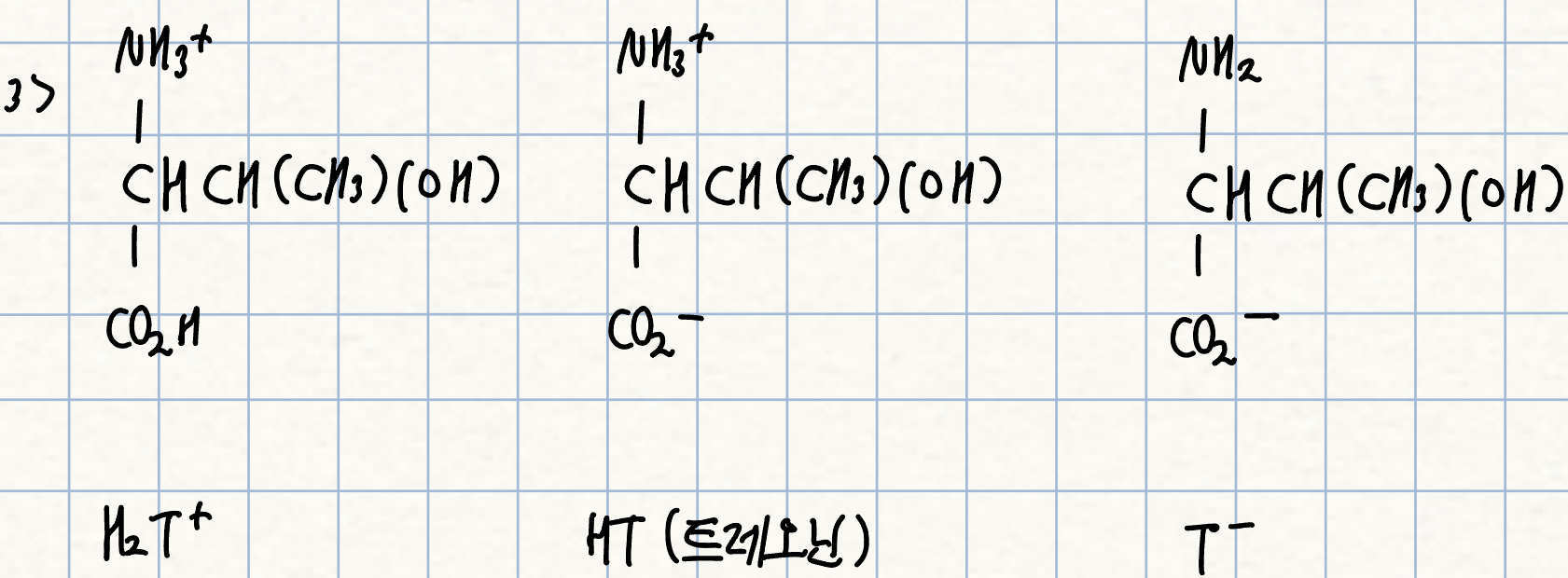
3. p. 240 자습
트레오닌의 세 가지 형태를 그리고, H2T+, HT, T-로 표기하시오. 어느 구조가 트레오닌인가?
풀이:
4.
4. 0.050 0 M H2L+, 0.050 0 M HL, 0.050 0 M L- 각 용액의 pH와 조성을 계산하시오.
각 단계에 대한 [H2L+], [HL], [L-]도 작성하시오.
(K1 = 4.70 x 10^-3, K2 = 1.80 x 10^-10)
(1) 산성 형태(H2L+) 용액의 pH?
(2) 중간 형태(HL) 용액의 pH?
(3) 염기성 형태(L-) 용액의 pH?
풀이:

5. 이양성자성 산의 중간 형태 공식과 단순화 시킨 식을 작성하라.
풀이:

6. p.246 예제
프탈산 수소 포타슘(potassium hydrogen phthalate, KHP)은 프탈산의 중간 형태의 염이다. 0.10 M과 0.010 M KHP 용액의 pH를 계산하시오.
(pK1 = 2.950, pK2 = 5.408)
풀이:

7. p. 246 자습
0.002 M K+HP-의 pH를 구하시오.
풀이:

8. p.247 예제
프탈산 수소 포타슘 1.00 g과 프탈산 이소듐 1.20 g을 물 50.0 mL에 녹여 만든 용액의 pH를 구하시오.
(KHP MW: 204.22, Na2P MW: 210.10)
풀이:

9. p. 247 자습
Na2P 1.20 대신 1.50 g을 사용하였을 때의 pH?
풀이:
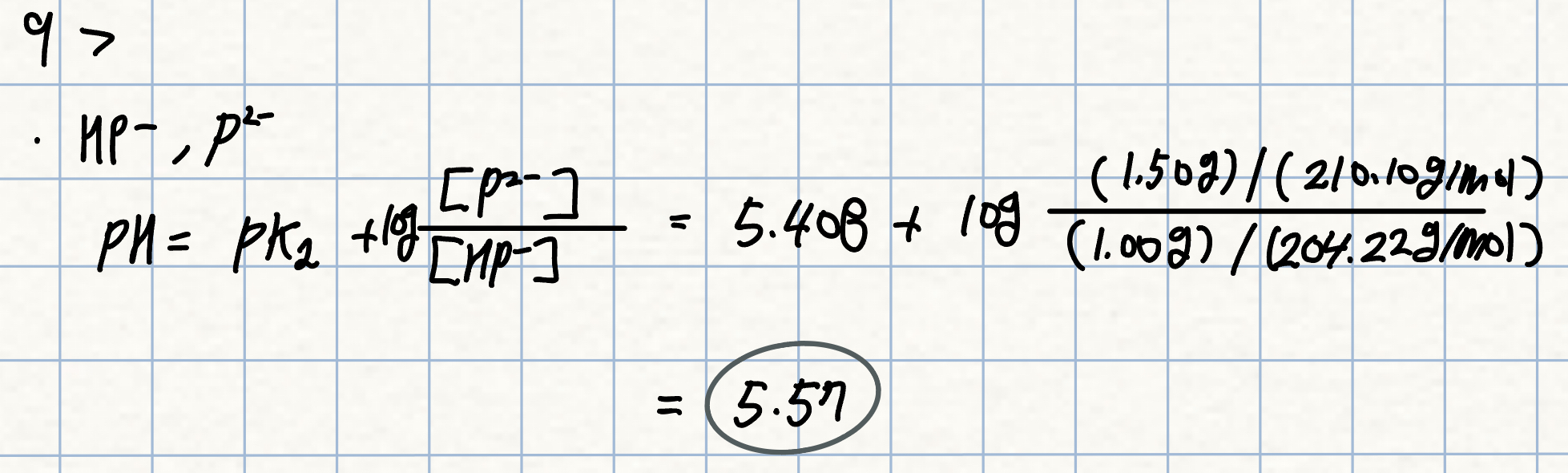
10. p. 247 예제
옥살산 3.38 g에 0.800 M KOH 용액 몇 mL를 가하면, 최종 부피를 500 mL로 했을 때 pH가 4.40이 되겠는가?
(참고: H2Ox MW = 90.03, pK1 = 1.250, pK2=4.266)

11. p.248 자습
pH를 4.50으로 만들기 위해 필요한 KOH의 부피는 얼마이겠는가?
풀이:

12. p. 249 예제
0.10 M H3HIS2+, 0.10 M H2His+, 0.10 M HHis, 0.10 M His- 각 용액의 pH를 구하시오.
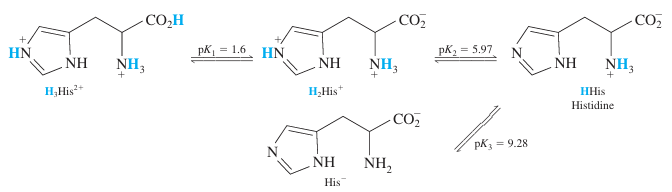
풀이:

13. p. 249 자습
0.010 M HHis의 pH를 구하시오.
풀이:
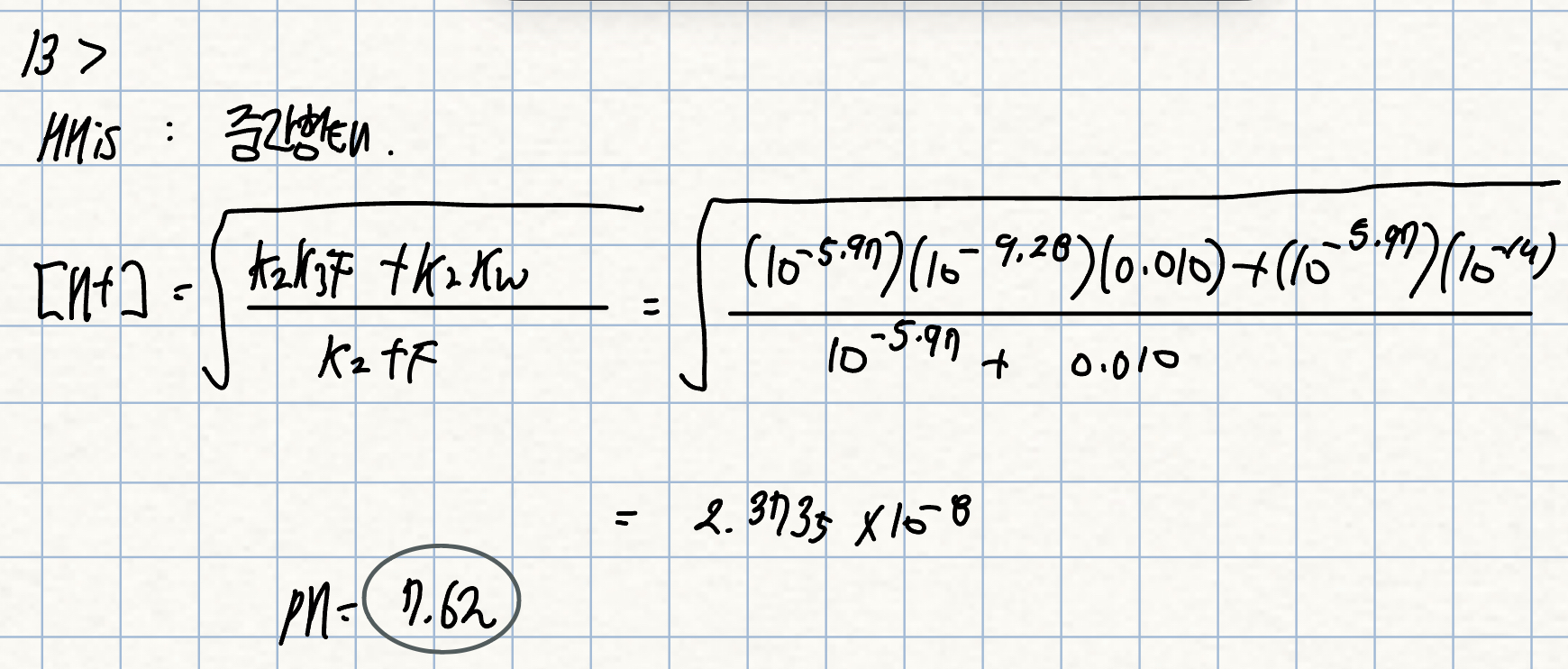
14. p. 250 예제
pH 7.0인 용액에서 암모니아의 주종은 무엇인가?
(참고: 암모늄 이온(NH4+, NH3의 짝산)의 pKa = 9.24)
풀이:
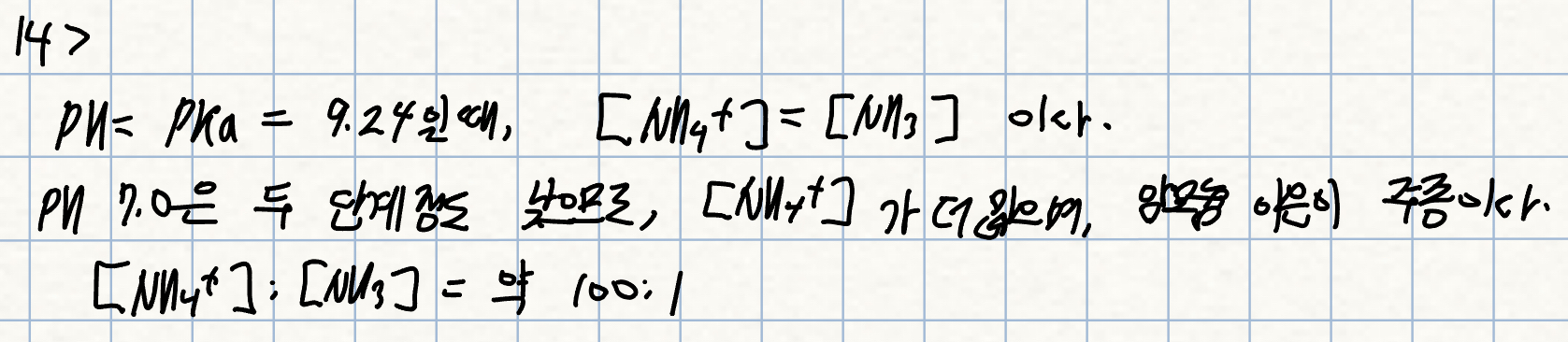
15. p. 250 자습
pH 11에서 NH3 형태로 있는 암모니아의 분율은 대략 얼마인가?
풀이:

16. p. 250 예제
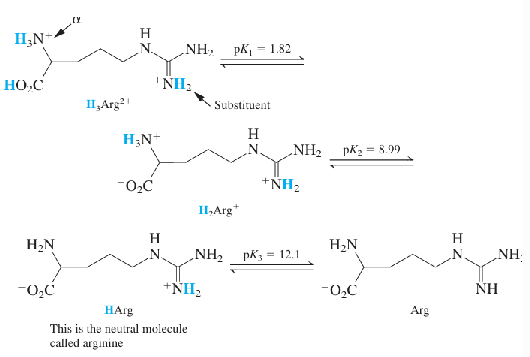
pH 10.0에서 아르지닌의 주종은 무엇인가? 그 형태로 있는 분율은 대략 얼마인가? 이 pH에서 두 번째로 많은 형태는 무엇인가?
풀이:

17. p. 251 자습
pH 11에서 아르지닌의 주종은 어떤 형태인가? 두 번째는 어떤 것인가?
풀이:

18. p. 251 예제
1.82~8.99의 pH 범위에서는 H2Arg+가 아르지닌의 주종이다. pH 6.0과 pH 5.0에서 두 번째로 많은 화학종은 각각 어느 것인가?
풀이:

19. p. 251 자습
[H2Arg+] = [Arg-]인 pH는?
풀이:
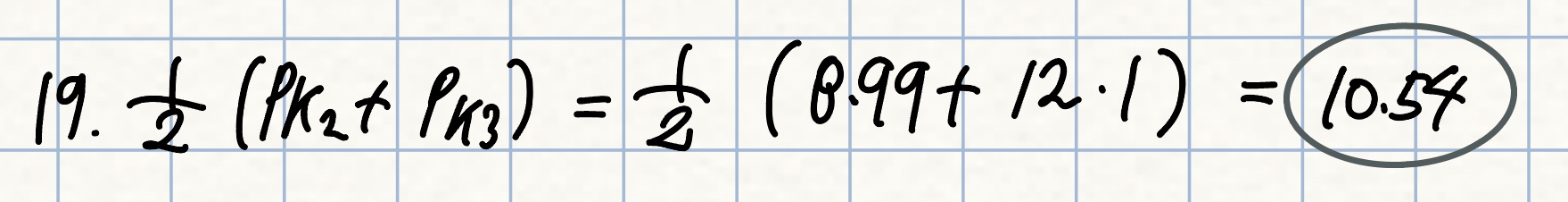
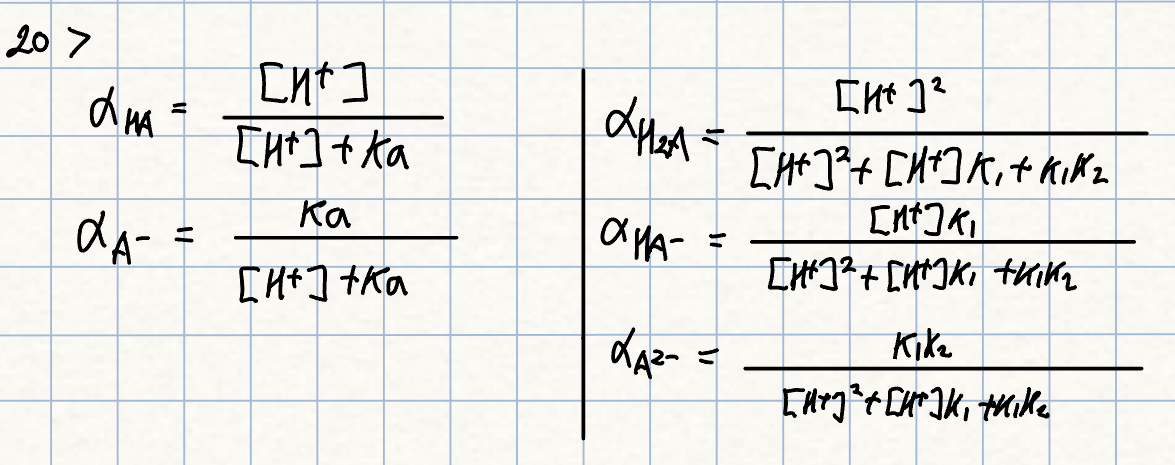
20.
일양성자성 계에서 HA와 A- 분율 식은?
이양성자성 계에서 H2A, HA-, A2- 분율 식은?
풀이: