목차
10-1. 이양성자성 산과 염기
10-2. 이양성자성 산의 완충 용액
10-3. 다양성자성 산과 염기
10-4. 어느 것이 주 화학종인가?
10-5. 분율 조성식
10-6. 등전 pH와 등이온 pH
10-4. 어느 것이 주 화학종인가?
- 산, 염기 또는 중간 형태 중 어느 것이 우세한 화학종인지 알아야 함
- ex) 크로마토그래피 또는 전기 이동으로 분리를 설계할 때
- 양이온, 음이온, 중성 화합물 각각에 대해 다른 분리 전략을 사용
Q. pH 8인 수용액에서 벤조산의 주된 형태는?

- 벤조산의 pKa = 4.20
→ pH 4.20에서 벤조산(HA)과 벤조산 음이온(A-)이 1:1 혼합물이라는 뜻
- pH = pKa + 1 (= 5.20)에서 [A-]/[HA]의 비는 10:1 임
- pH = pKa +2 (= 6.20)에서 [A-]/[HA]의 비는 100:1 임
- pH가 증가함에 따라 [A-]/[HA]의 비는 더욱 커짐
- 일양성자성 계에서 pH > pKa이면 염기성 화학종인 A-가 주종을 이룸
- pH < pKa이면 산성 화학종인 HA가 주종을 이룸
∴ pH 8에서 벤조산의 주종은 벤조산 음이온(C6H5CO2-)임
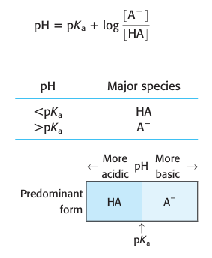
p. 250 예제 <주 화학종 - 어느 것이 얼마만큼?>
Q. pH 7.0인 용액에서 암모니아의 주종은 무엇인가? 그것의 분율은 대략 얼마인가?
- 부록 G를 보면, 암모늄 이온(NH4+, NH3의 짝산)의 pKa는 9.24 5임.
- pH = 9.24 5에서 [NH4+]=[NH3]임
- 9.24 보다 낮은 pH에서는 NH4+가 주종
- pH 7.0은 pKa보다 약 두 단위 낮으므로, [NH4+]/[NH3]의 비는 약 100:1임
- 즉, 99% 이상이 NH4+ 형태로 되어있음
p. 250 자습 <주 화학종 - 어느 것이 얼마만큼?
Q. pH 11에서 NH3 형태로 있는 암모니아의 분율은 대략 얼마인가?
- pH가 pKa보다 2 단위 정도 크므로, 99%보다 약간 모자라는 정도일 것임
다양성자성 계에서의 주 화학종
- 일양성자성 계와 이론은 같으나, 여러 pKa 값이 있음

- 옥살산(H2Ox)의 경우 pK1 = 1.27, pK2 = 4.27임
- pH = pK1에서, [H2Ox] = [HOx-]이고,
- pH = pK2에서, [HOx-] = [Ox2-]임
p.250 예제 <다양성자성 계의 주 화학종>
Q. 아르지닌(arginine) 아미노산은 다음 형태를 갖는다.

부록 G에 의하면 a-암모늄기(왼쪽)은 치환체(오른쪽)보다 산성이 더 강하다. pH 10.0에서 아르지닌의 주종은 무엇인가? 그 형태로 있는 분율은 대략 얼마인가? 이 pH에서 두 번째로 많은 형태는 무엇인가?
- pH = pK2 = 8.99에서 [H2Arg+] = [HArg]이며, pH = pK3 = 12.1에서 [HArg ] = [Arg-]임
- pH = 10.00에서 주 종은 HArg임
- pH 10.0은 pK2보다 약 pH 한 단위 크므로, [HArg]/[H2Arg+] = 10:1임 (대략)
- 아르지닌의 약 90%가 HArg 형태로 있음
- 두 번째로 많은 화학종은 [H2Arg+]로, 아르지닌의 약 10%를 차지
p. 251 자습 <다양성자성 계의 주 화학종>
Q. pH 11에서 아르지닌의 주종은 어떤 형태인가? 두 번째는 어떤 것인가?
- pH = pK2 = 8.99에서 [H2Arg+] = [HArg]이며, pH = pK3 = 12.1에서 [HArg ] = [Arg-]임
- pH 11에서 주 종은 HArg임
pH 11.0은 pK2보다 약 pH 한 단위 작으므로, [Arg-]/[HArg] = 1:10임 (대략)
- 두 번째로 많은 화학종은 Arg-임
p. 251 예제 <다양성자성 계에 대해서>
Q. 1.82~8.99의 pH 범위에서는 H2Arg+가 아르지닌의 주종이다. pH 6.0과 pH 5.0에서 두 번째로 많은 화학종은 각각 어느 것인가?
- 순수한 중간 형태(양쪽성 양성자성)인 H2Arg+의 pH는 다음과 같음
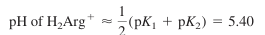
- pH 5.40 이상(그리고 pH = pK2 이하)에서 H2Arg+의 짝염기인 HArg가 두 번째로 중요한 화학종임
- pH 5.40 이하(그리고 pH = pK1 이상)에서는 H3Arg2+가 두 번째로 중요한 화학종일 것으로 예측
p. 251 예제 <다양성자성 계에 대해서>
Q. [H2Arg+] = [Arg-]인 pH는?

삼양성자성 계의 특성

- 용액의 pH와 pKa 값들을 비교함으로써 주종 결정 가능
종 규명(speciation)
:분석 물질이 여러 가능한 화학종에 분포되는 것
- 산과 염기에 대한 종 규명은 각 양성자성 형태가 얼마나 존재하는지를 나타내줌
- 부분적으로 양성자화된 다양성자성 산이나 염기는 다른 자리에 H+가 붙어 있는 여러 화학종을 가짐
- ex) 식수에 들어 있는 무기 비소산 (AsO(OH)3와 As(OH)3)을 섭취하면, 일부가 (CH3)AsO(OH)2, (CH3)As(OH)2, (CH3)2AsO(OH), (CH3)2As(OH), (CH3)3AsO, and (CH3)3As. 등과 같이 메틸화됨.
- 종 규명은 존재하는 형태와 양을 나타내줌
Keyword: 주 화학종, 종 규명(specification)



