2.1 원자 이론의 역사적 발전
2.1.1 주기율표
2.1.2 원자구성 입자(Subatomic Particles)의 발견과 Bohr 원자
2.2 Schrodinger 방정식
2.2.1 상자 속 입자(Particle in a Box)
2.2.2 양자수와 원자 파동함수
2.2.3 쌓음 원리
2.2.4 가려막기
2.3 원자의 주기적 성질
2.3.1 이온화 에너지
2.3.2 전자 친화도
2.3.3. 공유 반지름과 이온 반지름
2.2 Schrodinger 방정식(2)
2.2.3 쌓음 원리
- 쌓음 원리(aufbau principle)
- 원자 내 전자 쌓임은 양자수를 차례로 증가시켜 얻게 됨
- 양자수의 조합은 전자가 하나인 수소 원자 내 전자의 행동을 정확히 나타냈었음
- 그러나, 다전자 원자에서는 전자 간 상호작용 때문에 동일한 원자 내에 1개 이상의 전자가 궤도함수를 채울 경우 순서가 정해져야 함
- 가장 낮은 n, l, ml, ms 순서로 증가시키며, 나머지 전자들에 대해 알맞은 순서는 다음 3가지 규칙을 따름
1. 전자는 원자의 전체 에너지가 가장 낮은 궤도함수에 들어감.
- 이는 가장 낮은 n과 l 값이 먼저 채워짐을 뜻함
- 각각의 한 벌(p, d 등) 속 궤도함수는 같은 에너지를 갖고있으므로, ml과 ms 값의 순서가 모호해짐
2. Pauli 배타 원리(Pauli exclusion principle)
- 원자 내 각각의 전자가 고유한 한 벌의 양자수를 가져야 함
- 서로 다른 전자에 대하여 적어도 한 가지 양자수는 달라야 함
3. Hund의 최대 다중도 규칙(Hund's rule of maximum multiplicity)
- 저너자가 궤도함수에 가능한 한 전체 스핀(최대수의 평행 스핀)을 갖도록 들어가야 함
- 동일한 궤도함숭에서 2개의 전자는 두 전자가 서로 다른 궤도함수에 있을 때보다 정전기적 반발 때문에, 같은 궤도함수에 있는 전자는 서로 떨어져 있는 궤도함수에 있는 전자보다 높은 에너지를 갖게 됨
- 즉, 가능한 한 가장 낮은 에너지를 갖는다는 규칙

- 스핀 다중도(spin multiplicity)
: 짝짓지 않은 전자수에 1을 더한 값 또는 n+1
- 자기장하에서 알짜 자기모멘트의 배향에 의존하는 가능한 에너지 준위 수
- Hund 규칙은 같은 궤도함수 내에서 전자가 짝지을 때 요구되는 에너지의 결과
- 2개의 전자가 원자 주위의 동일한 공간 영역(같은 궤도함수)을 차지할 때, 서로 음전하 때문에 한 쌍의 전자당 Coulombic 반발 에너지(Coulombic energy of repulsion) Πc 만큼 서로 반발함
- 이 반발력은 동일한 궤도함수에 전자가 들엉가는 것보다 다른 궤도함수에 전자가 들어가는 것을 선호
- 교환 에너지(exchange energy) Πe
: 같은 에너지와 같은 스핀을 가진 두 전자 간에서 가능한 교환 방법의 수
- ex) 탄소의 전자 배치는 1s2 2s2 2p2임
- 2p 전자에 대하여 세 가지 전자 배열을 생각할 수 있음

- 각각의 전자 배열은 특정한 에너지 준위를 가짐
- 첫 번째 배열은 동일한 궤도함수에 전자쌍을 이루는 유일한 배열이므로 Coulombic 반발 에너지 Πc를 포함하고 있음
- 이 배열의 에너지는 전자-전자 간 반발의 결과 다른 두 경우보다 Πc만큼 에너지가 높음
- 처음 두 경우는, 똑같은 형태를 얻기 위해 전자를 배열하는 방법이 1가지 밖에 없음
(+ 또는 - 부호를 가진 전자가 하나밖에 없기 때문)
- 세 번째 경우 같은 스핀을 가지므로 전자를 서로 구별할 수 없음
- 전자 배열할 수 있는 두 가지 방법

- 세 번째 배열은 두 가지 방법이 있어 한 쌍의 전자가 두 방법 사이를 교환할 수 있고,
평행한 전자(스핀이 같은)의 교환으로 설명 가능
- 평행한 전자 간의 교환은 에너지가 관여하며 Πe로 표시
- 각 교환이 전자 상태를 안정화(낮은 에너지 상태)하며, 가능한 교환 방법이 많을수록 에너지는 낮아짐(Hund 규칙)
- 평행한 전자 교환이 1개 있는 세 번째 배열이 두 번째 배열보다 Πe만큼 낮아짐
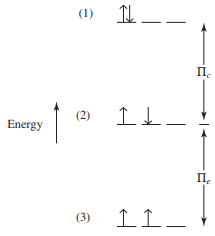
- p2 전자 배치에 대한 Coulombic 효과와 교환 에너지를 고려한 결과의 에너지 도표
- 세 번째 배열이 가장 안정하며, 각각의 전자는 서로 다른 궤도함수에 존재하고 평행한 스핀을 가짐
- 세 번째 배열은 평행한 스핀과 한 가지 교환이 가능하기 때문에 두 번째 배열보다 Πe만큼 2개의 전자가 같은 궤도함수에 존재하여 두 번째 배열보다 Πe만큼 높은 에너지 상태가 됨
- 첫 번째, 두 번째 배열은 교환에 의한 안정화가 없음(Πe = 0)
요약
- Coulombic 반발 에너지 Πc는 같은 궤도함수에 존재하는 전자 간의 반발에 의한 것이고, 쌍을 이루는 전자의 개수가 증가할수록 에너지 상태가 높아짐
- 교환 에너지 Πe는 서로 다른 궤도함수에 평행한 전자에 의한 것이고, 평행한 전자가 많을수록(많은 수의 교환) 에너지 상태가 낮아짐
- 서로 다른 전자 상태의 에너지를 비교할 때 교환 에너지의 Coulombic 에너지를 모두 고려해야 함
p. 32 예제문제2.2
Q. 4개의 p 전자를 갖고 있는 산소는 짝짓지 않은 2개의 전자를 가질수도있고, 짝짓지 않은 전자가 하나도 없을 수 있다.
a. 각각에 대하여 교환할 수 있는 전자수를 계산하고, 원자에 대한 Coulombic 에너지와 교환에너지를 계산하라.
p. 33 기본문제 2.4
p4의 세 번째 가능한 전자 배열은 다음과 같다.

이 전자 배열에 대한 Coulombic 에너지와 교환 에너지를 결정하고, 위의 예제와 비교 설명하라. 산소의 p4에서 세 가지 전자 배열에 대한 상대적인 에너지 상태를 개략적으로 그려라.

p.33 기본문제 2.5
3개의 p 전자를 갖고 있는 질소 원자는 3개의 짝짓지 않은 전자 또는 1개의 짝짓지 않은 전자를 가질 수 있다.
a. 각각의 경우에 있어서 교환할 수 있는 전자수를 찾고, 원자에 대한 Coulombic 에너지와 교환 에너지를 결정하라. 어느 배열의 에너지가 더 낮은가?
b. 2p3의 세 번째 가능한 전자 배열은 다음과 같다.

Coulombic 에너지와 교환 에너지를 결정하고 a번에서의 에너지와 비교 설명하라.

- 궤도함수가 축퇴(degenerate, 같은 에너지)되어 있는 경우 Coulombic 에너지와 짝지음 에너지는 짝지은 전자 배치 보다는 짝짓지 않은 전자 배치를 선호함
- 관여하는 준위 사이에 에너지 차이가 있으면 이 차이는 전체 짝지음 에너지와 결합하여 최종 전자 배치를 결정함
- 이는 원자에서 한 벌의 궤도함수(s, p, d)가 다른 궤도함수에 전자가 채워지기 전에 채워짐을 의미
- 그러나, 이는 몇몇 전이 원소에서는 맞지 않음
- 4s와 3d(또는 해당하는 높은 준위)의 에너지는 너무 가까워 짝지음 에너지가 준위 간 에너지와 거의 같음
(2.2.4절)
- 원자 궤도함수를 채우는 순서를 예측하기 위해 여러 체계가 사용됨
- 그 중 하난느 Klechkowsky의 규칙
- n + l 값이 가장 낮은 값으로부터 차례대로 궤도함수를 채운다는 것
- 두 가지를 조합하여 같은 값이 나오면 n 값이 작은 궤도함수를 먼저 채움
- 3d(n + l = 3 + 2)보다 4s(n + l = 4 + 0)에 먼저 전자를 채움
- 이 방법은 대부분의 궤도함수를 채우는 순서를 정해 줌

Keyword: 쌓음 원리(aufbau principle), Pauli 배타 원리(Pauli exclusion principle), Hund의 최대 다중도 규칙(Hund's rule of maximum multiplicity), 스핀 다중도(spin multiplicity), Coulombic 반발 에너지(Coulombic energy of repulsion), 교환 에너지(exchange energy), 축퇴(degenerate)



