[1. 전기화학의 이해]
전기화학
전기적인 효과와 화학적인 효과의 관계를 다루는 학문
응용 분야
재료
Electroplating
Electrorefining
Leaching
Cementation
Chlorine production
에너지
Battery
Fuel cell
Supercapacitor
Hydrogen production
환경
Sensor
Corrosion/Protection
ELectroflotation
Electrodialysis
Decontamination
전기화학 셀(Electrochemical cell)

- 전기화학 반응이 가능한 두 전극
- 이온의 전도가 가능한 전해질
- 전자의 흐름을 유지할 수 있는 외부 회로
산화반응(anode)
A →

환원반응(cathode)

전기화학 셀을 통해 진행
산화 반응, 환원 반응, 이온 이동, 전자 이동
- 전기화학 셀을 이용해 배터리, 연료 전지 등 제작
- 금속 스스로 셀을 만들어 부식 반응을 일으키기도 함
전위 (Electrical potential)
: 전기장 하에서 단위 양전하를 무한히 먼 곳으로부터 특정 지점으로 옮기는 데 필요한 일
- 상대적인 개념으로, 상대적인 값만 측정 가능
- V = IR
전기 에너지
전기 에너지 = 전위의 차이 x 전하의 양
전압(Voltage)
두 지점 사이의 전위 차이
전위(Electrical potential)와 전압(Voltage)의 차이
전위: 절대적 개념
전압: 상대적 개념
표준수소전극(Standard hydrogen electrode)
: 산화 환원 전위의 열역학적 기준이 되는, 표준 수소 전극
수소 이온과 전자가 만나서 수소 기체가 되는 반응을 기준으로 삼음 ( + V : 환원 반응, - V: 산화 반응)

수소 대비, 전자의 에너지가 높은쪽일수록 전위는 (-)가 됨
- Li : Li 안에 들어있는 전자의 E 높음 (-3.04 V)
- F : 수소 대비 전자의 E 낮음 (환원 반응, 2.87 V)
- 표준산화환원전위에서 두 반응식을 정해 셀 구동
- 금속이 전해질을 만나 산화 반응을 일으키며 부식 발생
다니엘 셀(Daniell Cell)
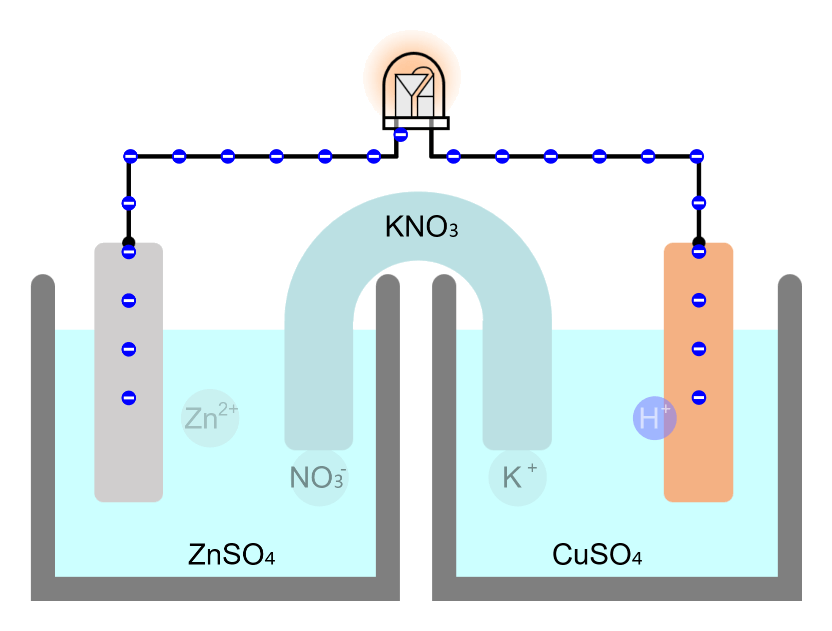

전위값(
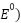
측정
- 두 개의 전극 선택
- 양의 값에서 음의 값을 빼면 항상 양의 값이 나옴
- 전자의 개수를 같은 값으로 맞춰 주면 전체 화학반응식 형성
→ Daniell cell: Ecu - Ezn = 1.1 V
기전력
: 절대적인 개념으로 양극과 음극의 전위 차
: 이론적인 셀의 전위 차(전압)
연료전지
: 수소와 산소의 반응
: EO2 - EH2 = 1.23 V
Potential을 통해 양극과 음극 정의 가능
음극(Negative electrode)
: in which electrons are more active
양극(Positive electrode)
: in which electrons are less active
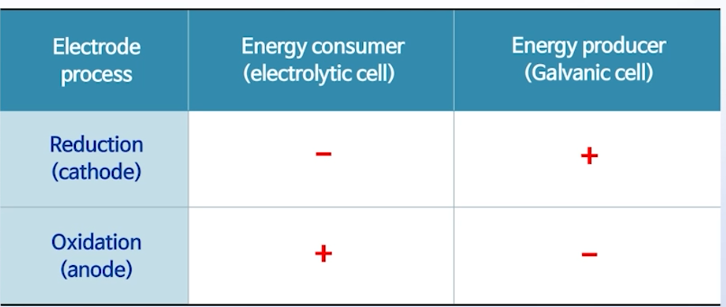
Galvanic cell
: 자발적으로 구동이 되는 셀
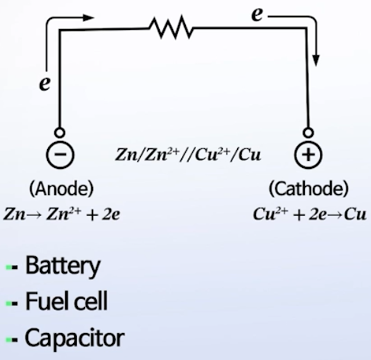
Galvanic Cell
- 음극에서 산화 반응이 일어나고,
- 양극에서 환원 반응이 일어남
Electrolytic Cell
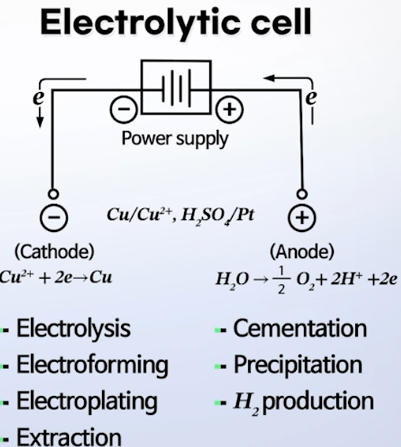
- 배터리의 충전과정이라 생각하면 됨
: 자발적이 아닌, 외부에서 전기를 가해 강제적으로 반응을 일으켜주는 것
Electrolytic Cell
- 음극에서 환원 반응이 일어나고,
- 양극에서 산화 반응이 일어남
Faraday’s Law
: 전기화학 반응에서 형성된 물질의 양은 흘러간 전하량에 비례한다
즉, 전기를 흘러준 만큼 어떤 물질을 얻을 수 있다는 것
F: Faraday Constant
: 전자 1몰이 갖는 전하량을 의미
식 해석) 물질의 몰수와 흘러간 전하량의 몰수가 같다는 것

- Li+와 같이 1가 반응을 보이는 리튬은 전하의 몰수와 물질의 몰수가 같아 n=1
- 2가 반응을 보이는 구리의 경우 n=2
→ 전하가 물질의 양보다 두 배가 되어야 함
구리 1몰을 얻기 위해, 전자 2몰이 필요!
→ 전기화학의 가장 기본 법칙인 패러데이 법칙
1C
1C = charge of 6.28 x
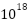
electrons
Avogadro’s number
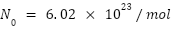
Faraday
number of charges that must passed to oxidize(reduce) one mole of a compound for one electron process

: 전자 1 mol이 96500 C만큼의 전하량을 가짐
단위를 바꾸면,
F=26.8 Ah
Current efficiency 전류 효율
: 흘러간 전자에서 얻은 금속의 비율
- 전자 100개 1가 반응에 대해 원자 100개 환원
- 만약, 전류 효율이 100%가 아니라면, 만약 전자 100개를 보내줬는데 80개만 얻고, 20개만 다른 방향으로 갈 경우
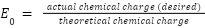
Voltage efficiency 전압 효율
: 전해 공정의 원활한 반응을 위해 이론적으로 필요한 전압보다 더 높은 전압이 요구됨
ex) 다니엘 셀에서, 1.1V의 전위 차가 발생하나, 충전 시 1.1 V 이상의 전압 필요
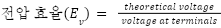
: 이론상 필요한 전압과 실제 필요한 전압의 비율을 백분율로 나타낸 것
Energy efficiency 에너지 효율
전기에너지 = 전압 x 흘러간 전하량
: 전류 효율과 전압 효율을 곱한 값
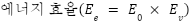
전해질의 역할
- 이온의 전도
- 전자의 이동 차단

전해질의 소재
수용액, 유기용액, 용융염,
고분자, 비정질 유리 등
- 전해질에서의 이온 전도 → 전류
- Migration: by potential gradient
- Diffusion: by concentration gradient
- 이온의 전도는 금속에서의 전자 전도와 다름
- 금속에서의 전자 전도는 개수도 많고 크기도 작음
이온의 전도와 전자 전도의 차이
- 전해질에 용해되는 이온 수는 금속에서의 전자 수보다 훨씬 적음
- 이온은 전자보다 크기가 큼. 이온 이동도가 금속에서의 전자 전도도보다 훨씬 낮음
→ 전해질에서는, 이온의 전도도가 금속에서의 전자 전도도보다 훨씬 낮음
예) 금속에서의 전자 전도도


→ 외부 도선을 통한 전자 이동보다 전해질에서의 이온 이동이 훨씬 더 느림
따라서, 느린 반응이 전체 반응을 통제할 수 있음.
전해질에 많은 관심을 가질 필요가 있음!
저항과 비저항
저항
: 전압을 전류로 나눈 값
비저항
: 소재 자체의 특성
전도도
: 비저항의 역수
Conducatance
: 옴의 역수인 S(simens)

전해질에서의 이온 전도도 온도 의존성
: 전해질 온도가 1도 변할 때마다, 이온 전도도 2.5% 변함

온도가 낮아지면, 그에 비례해서 전도도 또한 감소
낮은 온도에서는, 전도도가 낮기 때문에, 셀이 구동이 안될 수도 있음
금속에서의 전자 전도도는 반대 경향을 가짐
- 온도를 높일수록, 전자 전도도가 낮아짐
전해질에서 농도에 따른 이온 전도도의 변화
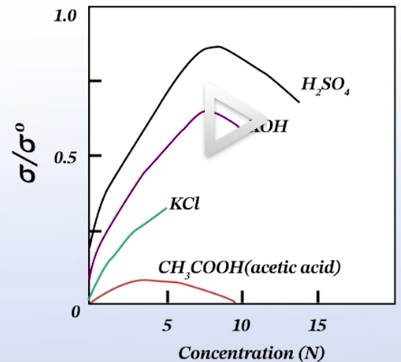
- 농도가 높아질수록, 전도 조금 더 용이, 농도가 너무 높아지면 큰 이온들끼리 부딪히거나 방해되어 농도가 너무 높아질 경우, 전도도가 오히려 감소함
→ 높은 이온 전도를 얻을 수 있는 전해질 농도를 확보해야 함
<전기화학 셀에 대한 열역학적 분석>
: 잠재적인 전기화학 반응에 대한 구동력의 방향과 크기 결정
- 열역학적으로 가능한 방향도 반드시 충분한 속도로 발생하지 않음
→ 반응에 대한 속도론적 분석 필요
Gibbs free energy
깁스 자유 에너지
: 일정한 온도/압력/닫힌계에서 가역적으로 발생하는 전기적 일은 깁스 자유 에너지 변화와 동일
- 열역학적인 분석을 통해, 깁스 자유에너지를 알게 되면 그걸 통해서 우리가 외부의 일을 얼마나 많이 해줄 수 있는지 알 수 있음
- 가역적인 계를 다룰 때, 최대한의 전기적 일을 계산할 수 있음
회로에서 발생하는 최대한의 전기적인 일
= 전하의 수 x 전위 차
공식

E-pH diagram
- Pourbalx diagram으로도 불림
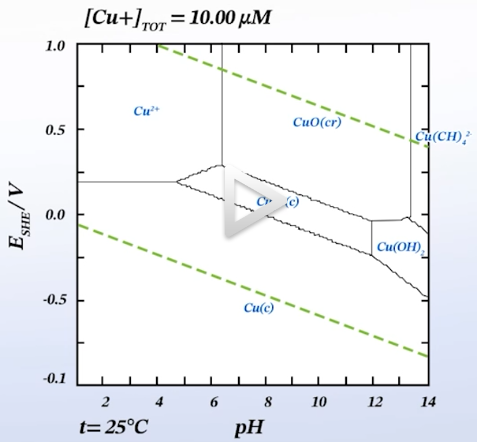
- 특정 금속이 수용액에서 어떤 상이 안정한지
- 경계는 Nernst equation을 통해 설정할 수 있음
- 경계를 통해, 가장 안정한 상을 판단할 수 있음
(금속, 이온, 산화물 상태 뭐가 더 안정한지)
- 예를 들어, 부식을 다룰 때 이 표를 통해 특정한 pH, 특정한 전위에서 이온으로 안정한지, 금속으로 안정한지, 산화물 상태가 안정한지 등을 판단 가능
- 이온 상태가 안정할 경우, 해당 금속은 이온화되어 부식 발생
→ 부식이 발생할 경우: 표면 코팅, 전위 변경, pH 변경을 통해 보호
표준산화환원전위(Standard Reduction Potentials at 25°C)

- 표준 상태(1 bar, unit activity)에서 산화/환원 반응의 표준 전위를 나타냄
- 기준 전극 = 표준 수소 전극
- 상대적으로 음의 값을 갖는 전극: 산화반응,
상대적으로 양의 값을 갖는 전극 : 환원반응 

<전기화학 속도론>
일반 화학 반응과의 차이
- 전자가 반응에 포함되어 있으며, 전기 에너지가 고려됨
- 일반적으로 전기 화학 반응은 불균일 화학 반응으로 전극 표면에서 전하의 이동에 의해 발생함
- 추가적인 구동력을 가질 수 있음
: 전위를 통해 반응을 통제할 수 있음
- 일반 화학 반응에서 사용하는 온도 증가와 촉매를 사용해 속도를 증가시킬 수 있음
율속 단계(Rate determining step)
: 전기화학 반응을 여러 단계로 나눌 때
가장 느린 단계가 전체 반응의 속도를 통제
- 율속 단계를 찾아 전기화학 반응 속도를 높일 수 있음
- 예) 전기화학 반응은 한쪽 전극에서는 산화 반응이 일어나고, 한쪽 전극에서는 환원 반응이 일어나니까, 그 사이에서는 이온의 이동이 동시에 일어나게 되는데, 속도가 가장 느린 특정 반응을 찾아 조치를 취할 수 있음
- 율속 단계를 찾는 것이 전기화학 속도론에서 매우 중요함
전기화학 반응 속도와 변수
- Potential: related with energy for reaction
- Current density: 반응 속도
과전압(Overvoltage)
: 열역학적으로 결정된 전위값과 실제 실험적으로 측정된 값의 차이
전해 반응
열역학적으로 기대되는 값보다 추가로 필요한 에너지
⬍
갈바니 반응
열역학적으로 기대되는 값보다 손실되는 에너지
- 손실된 전압 또한 과전압에 해당
과전압의 종류
: 활성화 과전압, 농도 과전압, IR 과전압
- Activation overpotential
: 전극 표면에서 이온으로의 전자 이동과 관련
- 전극 표면에서 전자가 이동할 때 에너지 장벽을 넘기 위해 필요한 과전압
- 이온의 이동은 충분한데, 이온 앞에 방해 때문에 장벽을 넘지 못하는.
- 일반적으로, 전류 밀도가 낮을 때 발생하는 과전압
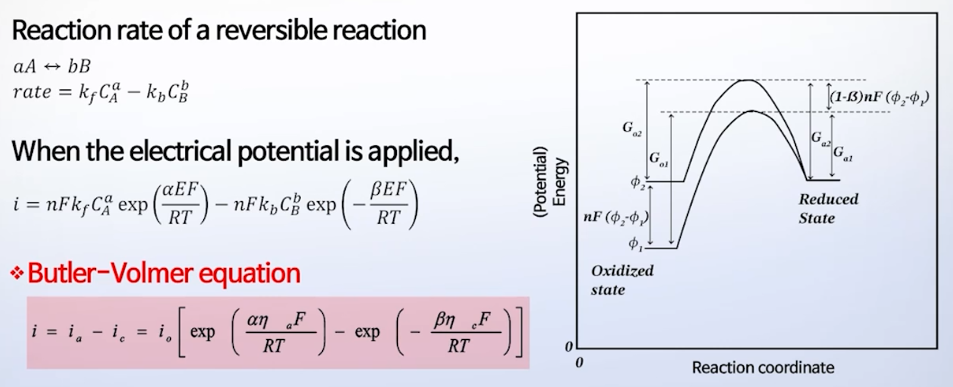
* Butler-Volmer equation
: 과전압과 전류 사이의 관계식
* Tafel Equation (과전압이 높을 때)
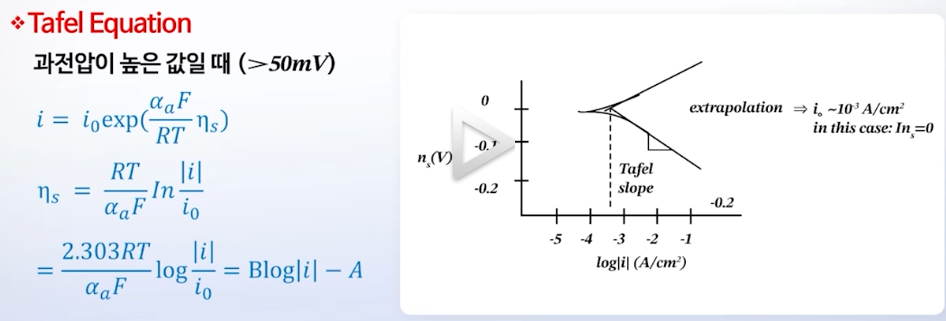
- 직선 부분: Tafel Equation이 적용되는 영역
- 전류 밀도를 10배 올릴 때 과전압이 얼마 필요한지 등 계산 가능
2. Concentration overpotential
: 전해질 bulk에서 전극 표면의 이온 농도차에 의해 이온이 이동하는 경우 발생
- 전극 표면에서 전하와 이온의 이동을 위한 확산 시 발생하는 과전압
- 확산 속도가 빠른 경우, 과전압이 적게 걸리며, 반응이 원활하게 진행
- 확산 속도가 느린 경우, 과전압이 많이 걸리며, 반응 제한
- 과전압 발생 시 빠른 이온 확산을 위한 조치 필요
3. Potential drop(IR drop)
: 전자 및 이온 전도에서 소재의 저항에 의해 발생
- 과전압이 많이 걸리는 곳을 파악해 전기화학 반응 속도를 일 수 있음


