E-모빌리티 시대를 여는 배터리 기술
2강. 배터리 작동 원리와 전기화학 기초 이론
학습내용
- 배터리 이해를 위한 전기화학 주요 용어
- 배터리의 구성 요소 및 작동 원리
학습목표
- 배터리 학습을 위한 전기화학 기본 용어를 설명할 수 있다
- 배터리가 작동하기 위한 필수 구성 요소를 파악하고, 구동 원리를 설명할 수 있다
1> 배터리 이해를 위한 전기화학 주요 용어
1. 전류와 전자의 흐름 방향

- 전류는 양극에서 음극으로 흐름
- 전자의 흐름 방향은 전류와 반대
전류
- 19세기 초 전자의 존재는 모르고 단순의 전기가 있다는 정도만 인식함
- 전류는 전기적 현상을 띠는 양전하(Positive Charge)가 도선을 따라 흐르는 것이라고 정의함
I = dQ/dt
- 전기(전하)가 흐르는 속도
- 단위: 암페어(A)
- 전하(Q) 단위: C(쿨롱, Coulomb)
- 시간(t) 단위: s(초)

- 물이 높은 곳에서 낮은 곳으로 흐르는 것을 생각하며,
전류도 높은 전위에서 낮은 전위로 흐른다고 약속함
2. 전류의 개념
1 Ampere = 1 Coulomb per Second (1 A = 1 C/s)

- I = dQ/dt
- dQ = Idt
- Q = I x t
3. 페러데이 상수
- 페러데이(Faraday) 상수란?
: 전자 1몰(Mole)의 전하량
- 1 F = 96485 C
- 전자 1개의 전하량 : 1.602 x 10^-19C
- 1 F
= 1.602 x 10^-19 C x NA
= 1.602 x 10^-19 C x 6.022 x 10^23
= 96485 A S
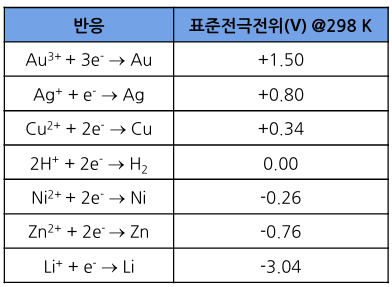
4. 표준전극전위
- 표준전극전위가 높을수록 환원 반응 경향성이 높음
- 열역학 함수 중 하나인 깁스자유에너지의 전기화학적 표현

- 표준수소전극(SHE)를 기준으로 삼음
: SHE는 모든 온도에서 0으로 정의
- SHE 표준상태: H+ 활동도 = 1, 수소 기체의 압력 = 1기압
- 전위가 클수록
: 환원 경향성이 큼
: 환원 반응이 잘 일어남
: 산화 반응이 일어나기 어려움
: 금의 산화 반응이 상대적으로 어려움
- 전위가 작을수록
: 산화 경향성이 큼
: 산화 반응이 잘 일어남
: 리튬이 가장 잘 산화됨 (표의 금속 기준)
5. 산화 반응과 환원 반응
- 전기화학 반응의 종류
- 산화 반응(Oxidation)
: 산화수가 증가하는 반응
: 반응물이 전자를 잃는 반응
: 반응 후 전자 생성
: 환원체 → 생성물 + e-
ex) Zn → Zn2+ + 2e-
- 환원반응(Reduction)
: 산화수가 감소하는 반응
: 반응물이 전자를 얻는 반응
: 산화체 + e- → 생성물
ex) Fe3+ + e- → Fe2+
- 반응의 종류에 따른 전극 구분
1) 캐소드(Cathode)
: 환원 반응(Reduction)이 일어나는 전극
2) 애노드(Anode)
: 산화 반응(Oxidation)이 일어나는 전극
6. 양극과 음극
- 전극전위에 따른 전극 구분
- Positive Electrode
: 선택된 두 전극 반응 중 전극전위가 높은 전극
: Plus(+) 전극
- Negative Electrode
: 선택된 두 전극 반응 중 전극전위가 낮은 전극
: Minus(-) 전극
- 전지 분야에서 양극과 음극의 정의
- 양극
: Positive Electrode
: 캐소드 (환원전극)
- 음극
: Negative Electrode
: 애노드 (산화전극)
2. 배터리의 구성요소 및 작동 원리
1. 전지의 구성과 작동 원리
- 구리와 아연 두 전극으로 이루어진 전극
: 구리 전극의 표준전극전위가 높기 때문에 구리 전극에서 환원 반응이 일어남
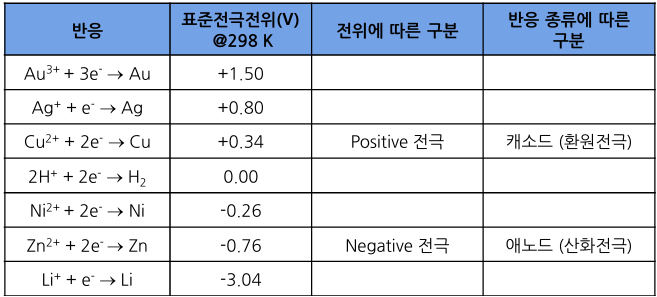
- 다니엘 전지
- 전위가 다른 두 전극을 연결하면 반응이 자발적으로 일어남
: 구리(Cu) 전극에서 환원 반응: Cu2+ + 2e- → Cu
: 아연(Zn) 전극에서 산화 반응: Zn → Zn2+ + 2e-
- 전자의 방향: 애노드 → 캐소드
- 이온의 방향
1) 양이온: 애노드 → 캐소드
2) 음이온: 캐소드 → 애노드
<전위와 전압>
- 전위
: Potential
: 절대적 개념
: 산의 높이를 측정할 때 사용하는 해발 개념과 유사함
- 전압
: Voltage
: 상대적 개념
: 두 산의 높이 차 개념과 유사함
: 두 전극의 전위차
<전지 작동 원리 개념도>
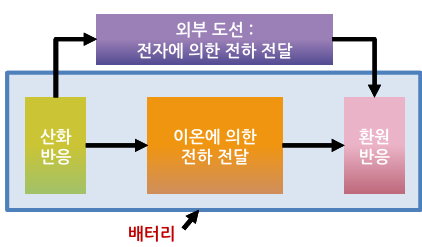
- 배터리 내부
- 전극: 산화 반응과 환원 반응이 동시에 발생
- 양극과 음극 사이에서는 이온에 의한 전기 전달
- 외부 도선
- 전자에 의한 전하 전달
- 전지 작동 원리의 핵심
: 산화 반응, 환원 반응(전자가 참여하는 반응), 전자와 이온
<전지의 역사>
1) 볼타 전지의 발명: 1799년 이탈리아의 물리학자 볼타
2) 전자의 발견: 1897년 영국의 물리학자 톰슨 → 1906년 노벨 물리학상
3) 이온의 발견: 1883년 스웨덴의 화학자 아레니우스가 제창 → 1903년 노벨 화학상
- 전지 작동에 필수적인 전자와 이온에 대한 지식이 전혀 없는 상태에서 전지가 거의 100년 전에 발명
<방전>
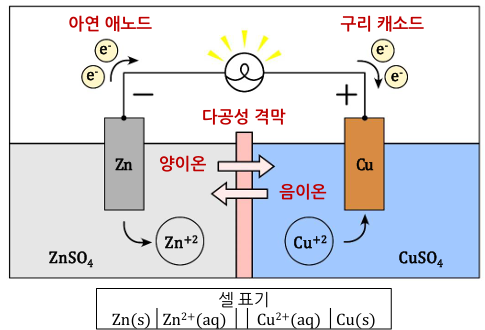
- 도선을 연결하면 반응이 자발적으로 일어나고, 전구에 불켜짐
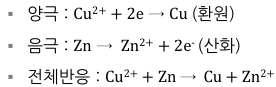
- 전자는 음극에서 생성되고 양극에서 소모 → 전체 반응식에 나타나지 않음
- 자발적 반응을 통해 화학에너지가 전기에너지로 변환되면서 외부 장치에 에너지를 전달함
<충전 과정, 비자발적 반응>
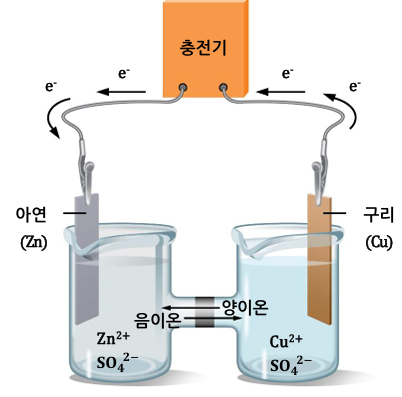
- 충전기를 이용하면 전자의 흐름 방향을 반대로 바꾸는 것이 가능함
- 전자의 방향: 구리 전극 → 아연 전극
구리 전극: 애노드
아연 전극: 캐소드
- 전위는 여전히 구리가 아연보다 더 높음
- Positive Electrode: 구리
-Negative Electrode: 아연
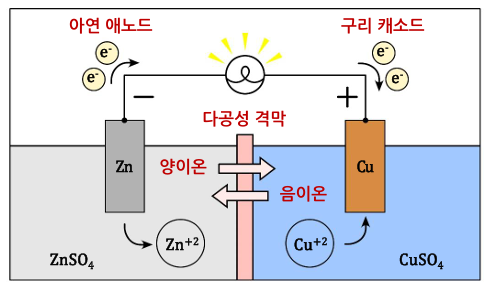
- 충전, 방전 정리
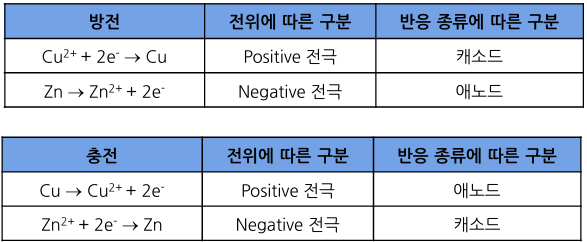
- 전지 분야에서는 혼동을 피하기 위해 방전 반응을 기준으로 양극과 음극을 정의
: 환원 반응(Reduction)이 일어나는 전극을 충전/방전에 관계없이 양극(Cathode)으로 약속
: 산화 반응(Oxidation)이 일어나는 전극을 충전/방전에 관계없이 음극(Anode)으로 약속

