이차전지공학 및 실습
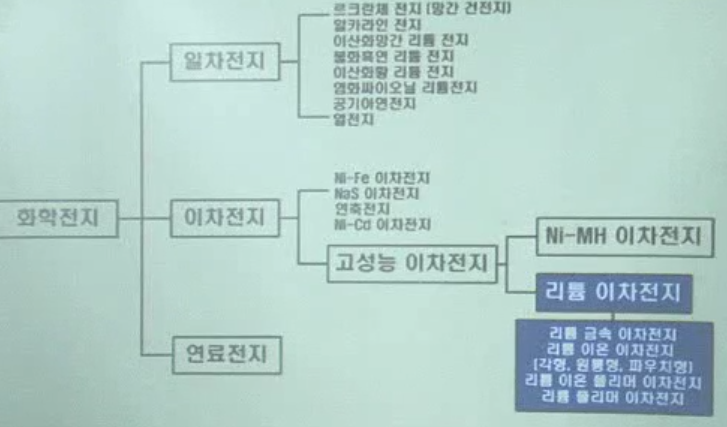
1. 화학전지
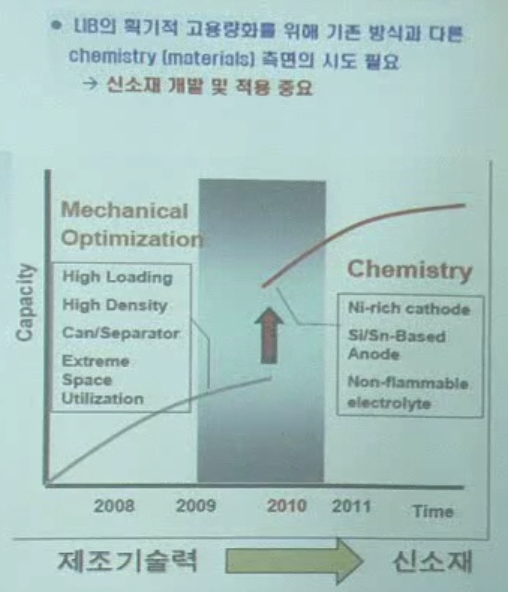
2. 리튬 이차전지
- 리튬 이차전지 원리
- 주요 소재
- 응용 분야
연료전지


redox-flow battery ex. vanadium oxide 전지
대용량 저장. 밖에 tank가 있음
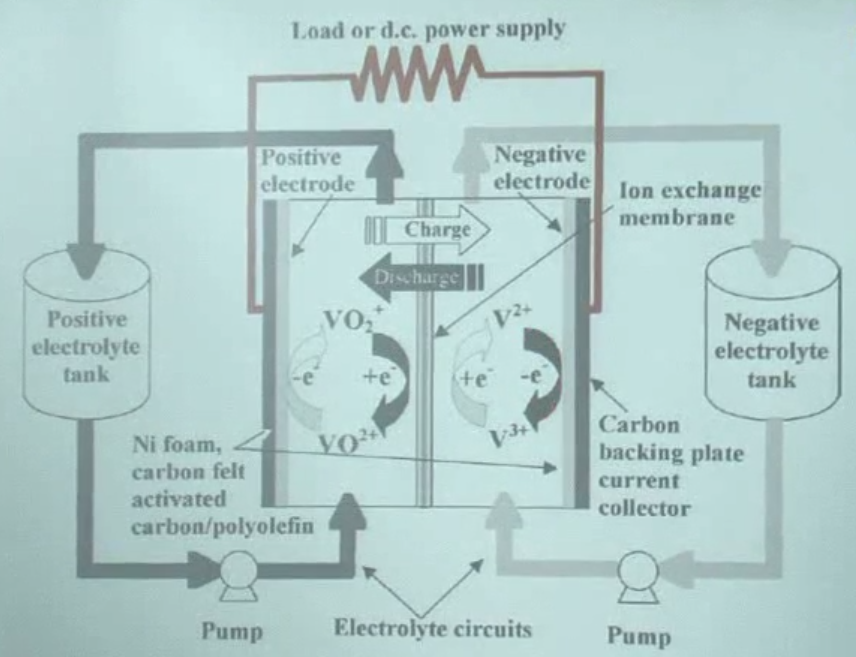
전극 표면에서 redox 산화 환원 반응
이차전지 역사

리튬이온전지 구성요소

초반) 음극 Li metal 이용
→ 이후 음극 흑연 이용 (두 소재 모두 intercalation)
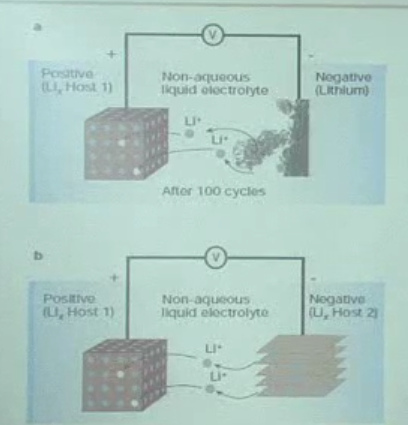

Li+ : charge carrier
층상계 양극소재 (LiCoO2)
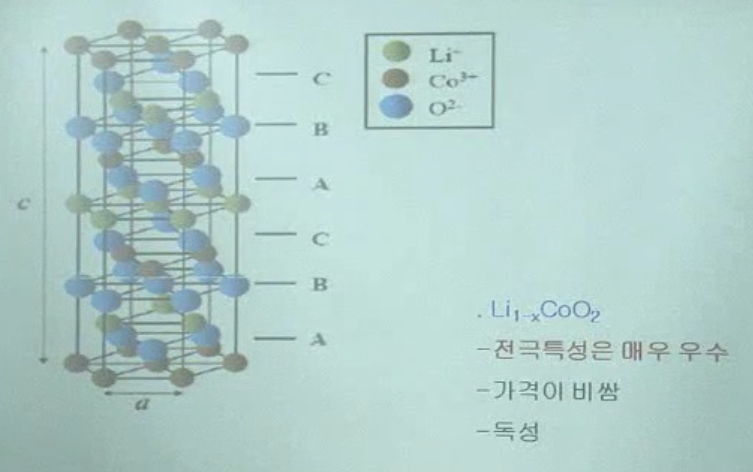
금속 이온이 2차원 평면으로 존재 = 금속 이온이 들어갈 수 있는 intercalation site가 2차원 평면을 갖고있다는 것 : 층상계
스피넬계 양극소재(LiMn2O4)
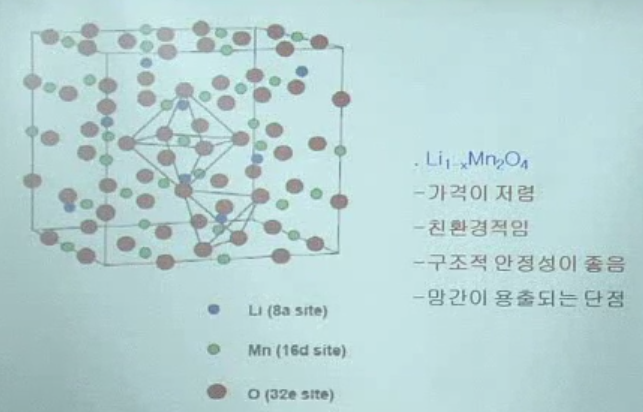
Li 이온 통로가 3차원적으로 연결되어있음
올리빈계 (LiFePO4)
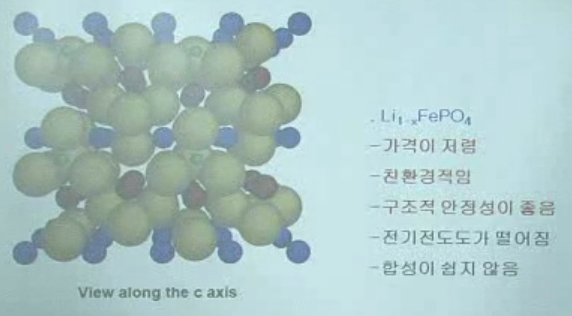
- 커다란 산소층 사이사이에 Li, Fe, P이 위치
- 전기전도도가 떨어짐
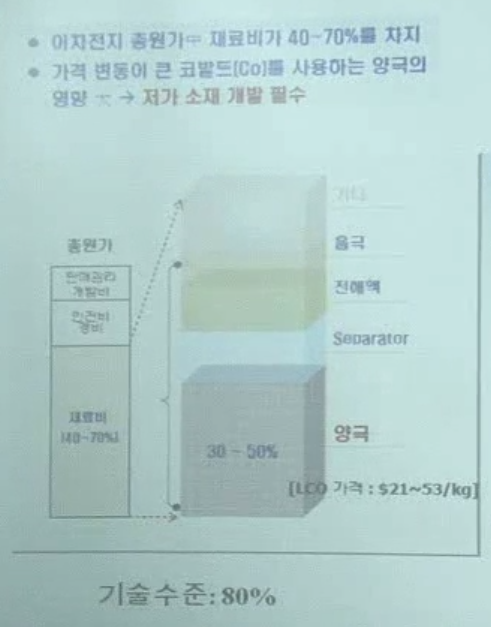
양극소재 볼 때 주의점:
(1) electrical conductivity
(2) Li ion diffusion
옛날) 음극 : Li metal 사용
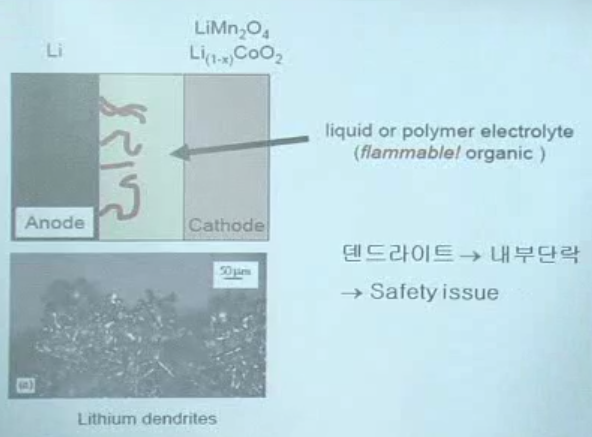
-> 흑연 사용
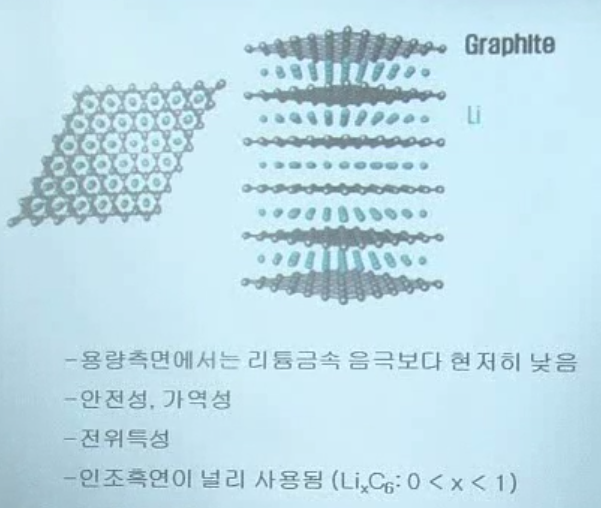
- 인조흑연: 높은 온도의 furnace에서 가열해야 함. (비용 많이 듦) -> 단가 낮출 필요성
인공 흑연 + soft carbon (비정질 흑연)을 섞어 사용하기도 함
유리한점: soft carbon은 층간 간격이 더 넓어서, Li 이온이 빠져나오기 월등히 유리 -> 출력 좋음
단점: 용량이 적음
대안
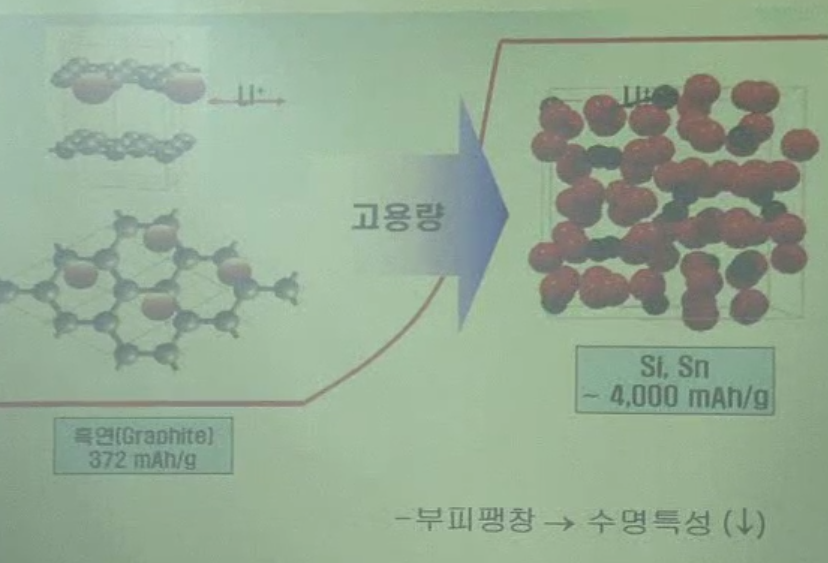
- SI는 Li metal보다 g 당 용량이 좋음.
단점: 기존 탄소계 재료는, 탄소 층 사이의 2차원 Li intercalation plane이 있어, 그 plane에서 왔다갔다 intercalation 반응.
합금계는 새로운 bond 형성. 새로운 bonding. 상전화. 부피팽창. 300% 정도. 팽창, 수축 반복 -> 수명 열화
음극 소재(나노 전이금속 산화물)
ex) cobalt oxide, Fe, Cu 산화물 등
나노입자일 땐 화학적 반응성이 높아져서, 가역적으로 반응이 일어난다는 것.
Li2O 내애 Co가 골고루 분산되어있는 것

전해질 종류
- 전해질) 물 -> 유기용매 변화.
물 Potential window: 1.5V임
활물질 전기화학 반응이 넓다고 하더라도, 물이 먼저 전기분해 되기 때문.
납축전지: 백금 전극에서는 반응이 빨리 일어나고, 어떤 전극에서는 느리게 일어나고 이용해서 전압 올린 case. 1.9V 정도의 전압.
알칼라인 전지 1.2~1.3V
Li 2차전지: 3.7~4V : potential window가 넓은 유기용매를 전해질로 사용하기 때문.
유기용매는 물과 다르게 분해가 잘 안된다는 것.
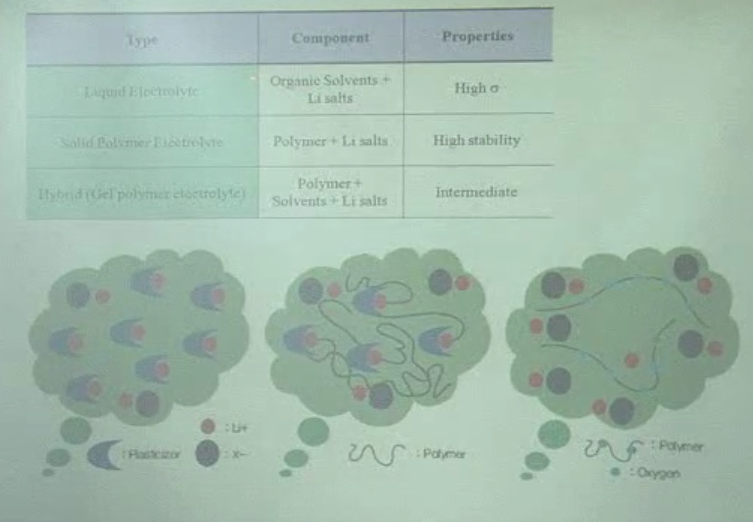
- Li 염 사용
- 액체 전해질, 고분자 전해질, 겔-폴리머 전해질
액체 전해질: 유기용매에 Li 염이 녹아있는 상태(Li ion이 solvation 되어있는)
음이온은 커서, 유기용매에 solvation이 되지 않음.
고분자 전해질: 유기용매가 하나도 없음. 고분자 matrix 안에 oxygen이 있음.
산소가 전기음성도 굉장히 큼. LI 이온과 electrostatic bonding을 형성하며, Li 염이 고분자 matrix 안에 녹아있는 형태.
Li 이온 움직이는 방법: 고분자 chain은 상온에서 미세한 열운동함. 사슬의 움직임에 의해 Li이 움직이며,
또는, 충방전을 하면, 즉 전기장을 걸게 되면, Li ion도 charge를 갖고있기 때문에 움직임.
∴ polymer 사슬 구조 중요. 사슬 사이에 어떻게 극성 분포시키는가 등, Polymer 사슬 유연해야 함(열에 의해 쉽게 움직일 수 있도록)
Polyethelene oxide 계통의 고분자 사용했었음. 이건 온도에 따라 굉장히 민감. 온도가 올라갈수록, 액체 전해질에 가까운 전도도 가짐 (고온 이차전지)
고분자 전해질 장점: 액체전해질과 달리, 고체이기 때문에 누액 걱정 없음. 전고체 전지.
Gel-polymer 전해질:
고분자 chain 자체는 견고한 것을 사용. (rigid)
고분자 사슬이 서로 매듭이 지어지게끔 network. 이 사이에 유기 용매를 채우고, 여기에 Li+이 solvation 되어있는 형태.
= 유기용매가 고분자 matrix에 함층되어있는 구조임.
-> 얼마나 고분자 matrix가 유기용매와 친화성이 있는가. (극성-극성 interaction)
-> 액체 전해질을 잘 머금고 있도록.
고분자 무게 대비 액체 전해질의 weight ratio 높이는 것이 중요. 1~5 wt% (2009')
Li ion이 고분자 matrix와 직접적인 관련성이 없음. 오로지 유기용매과 고분자 chain 간의 interaction이 있는 것.

분리막
셀가드(Celgard)
- 3층 PP/PE/PP
다공성 구조. 기공성 부피가 50%. 빈 공간에 액체 전해질이 차는 것.
역할)
- 양극과 음극을 전기적으로 분리
- 이온에 의한 전하 전달. (전해액 이동 통로)
시사성)
- 기공의 크기 잘 조절
- 이물질 미세 short 단락에 의해 분리막 구멍나지 않도록 잘 견뎌야 함.

바깥(양극, 음극과 바로 맞닿는 부분)은 미세한 구멍(단락 방지, separator가 뚫리지 않도록), 안쪽(가운데)는 크게(이온 전도도 측면에서 유리)

