<목차>
9-1. 강산과 강염기
9-2. 약산과 약염기
9-3. 약산의 평형
9-4. 약염기의 평형
9-5. 완충 용액
9-5. 완충 용액 (1)
완충 용액(buffer)
산이나 염기가 첨가되거나 묽혀져도 pH 변화를 막는 용액
- 산이나 그 짝염기의 혼합물로 이루어짐
- 짝산과 짝염기의 양이 서로 비길 만큼(10배 이내에서) 되어야 함

- 리소좀의 소화 효소가 산성 조건에서 가장 잘 작동
→ 세포가 자신의 효소로부터 스스로 보호하기 위한 것
- 만약 산성의 리소좀에서 효소가 중성으로 완충된 세포질로 나와도, 효소의 반응성이 떨어져 최적 pH에 비하여 세포에 끼치는 손상이 작을 것
- 반대로, 위 그림은 pH 8 근처에서 가장 빠르고, 산성의 리소좀 안에서는 느려질 것
- 어떤 기관이라도 살기 위해서, 각 소세포(subcellular) 구역 내의 pH를 조절해서 효소 촉매 반응들이 적당한 속도로 진행되도록 해주어야 함
약산과 그 짝염기의 혼합
- 약산 A몰과 그 짝염기 B몰을 섞으면 산의 몰수는 A에 가깝게 유지, 염기의 몰수는 B에 가깝게 유지됨
(어느 쪽의 농도도 바꿀 만한 반응은 거의 일어나지 않음)
∵ Le Chatelier 원리
Q. pKa = 4.00이고, pKb = 10.00일 때, 0.10 M HA 용액에서 해리하는 산의 분율?

- 이 조건에서는 산의 3.1%만이 해리함
Q. 0.10 mol의 A-가 녹아 있는 1.00 L 용액에서 A-가 물과 반응하는 정도?

- 순수한 HA는 아주 조금 해리하는데, 그 용액에 여분의 A-를 가하면 HA는 훨신 덜 해리함
- A-는 물과 그다지 많이 반응 X, 여분의 HA를 가하면 A-의 반응은 더욱 감소
- 0.050 mol의 A-와 0.036 mol의 HA를 물에 가하면 평형 상태에서 용액 중에는 거의 0.050 mol의 A-와 0.036 mol의 HA가 존재
Henderson-Hasselbalch 식
- 완충 용액을 다루는 주된 식
- 이 근사는 아주 묽은 용액이나 극단적인 pH에서는 성립되지 않음
([ A- ]와 [HA]를 사용할 때 근사 사용)
- 평형식 Ka를 단순히 재배열한 것

산의 Handerson-Hasselbalch 식

- 산의 pKa와, 짝산과 짝염기의 농도비를 알면 용액의 pH를 알려줌
염기의 Henderson-Hasselbalch 식

- 위 2개의 식에서 염기(A- 또는 B)가 두 식의 분자에 나타나고, 반응의 평형 상수는 분모에 있는 산의 Ka임
활동도를 무시하지 않은 Henderson-Hasselbalch 식

Henderson-Hasselbalch 식의 성질
- [ A- ] = [HA]이면 pH= pKa
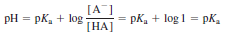
- 평형 상태에 있는 어떠한 용액에서도 모든 평형이 동시에 만족되야 함
- 용액에는 하나의 H+ 농도만이 존재
- [ A- ]/[HA] 비가 10배 변할 때마다 pH는 한 단위 변함
- 염기( A- )가 증가하면 pH는 올라감
- 산(HA)이 증가하면 pH는 내려감
p. 223 예제 <Henderson-Hasselbalch 식의 이용>
Q. 하이포아염소산 소듐(NaOCl, 거의 모든 표백제의 활성 성분)을 pH 6.20인 완충 용액에 녹였다. 이 용액의 [OCl-]/[HOCl]의 비를 구하시오.
※ 하이포아염소산(HOCl)의 pKa=7.53

→ pH와 pKa를 알기만 하면 됨
→ NaOCl을 얼마나 첨가했다거나, 용액의 부피가 얼마인지에 대해선 알 필요 없음
p. 223 자습 <Henderson-Hasselbalch 식의 이용>
Q. pH를 한 단위 올려서 7.20으로 만들었을 때 [OCl-]/[HOCl]를 구하시오.

완충 작용
- 트리스(하이드록시메틸)아미노메테인 = 트리스(tris) : 아주 널리 쓰이는 완충제

- 트리스의 짝산에 대한 pKa = 8.072
- BH+ 양이온을 갖는 염의 예로는 트리스 염화수소, 실제로는 BH+CL-임
- BH+CL-를 물에 녹이면 BH+와 CL-로 완전히 해리됨
p. 224 예제 <완충 용액>
Q. 트리스(FM 121.135) 12.43 g과 트리스 염화수소(FM 157.59) 4.67 g을 물에 녹여 1.00 L로 만든 용액의 pH를 구하시오.
- 용액에 첨가한 B와 BH+ 의 농도 구하기

- 섞은 그대로 존재한다고 가정, 이 농도를 Henderson-Hasselbalch 식에 대입하여 pH 구하기

p. 224 자습 <완충 용액>
Q. 트리스 염화수소 1.00g을 첨가했을 때의 pH를 구하시오.
※ 트리스 12.43 g, 트리스 염화수소 5.67 g

- pH를 구하는 데 용액의 부피는 관계 없음

보충 9-3 <센 것과 약한 것은 완전히 반응한다>
- 강산은 평형 상수가 크기 때문에 약염기와 본질적으로 '완전히 반응

- B가 트리스(하이드록시메틸)아미노펜테인이면, HCl과의 반응에 대한 평형 상수는

- 강염기는 평형 상수가 역시 매우 크므로 약산과 완전히 반응

- HA가 아세트산이면, NaOH와의 반응에 대한 평형 상수는

- 강산과 강염기의 반응은 강산과 약염기의 반응보다 더 완전함

- 만약 강산, 강염기, 약산, 약염기를 섞으면 강산과 강염기 중 어느 쪽이 없어질 때까지 서로 반응하고, 그 다음 남은 강산 또는 강염기가 약염기 또는 약산과 반응함
p. 225 예제 <완충 용액에 산을 첨가한 효과>
Q. 앞의 예제에서 사용한 용액에 1.00 M HCl 12.0 mL를 가하면 새로운 pH 값은 얼마나 되는가?
- 핵심: 약염기에 강산을 첨가하면, 완전히 반응하여 BH+로 됨을 인식
- 1.00 M HCl 12.0 mL에는 (0.012 0 L)(1.00 mol/L) = 0.012 0 mol의 H+가 들어있음
- 이 H+는 0.012 0 mol의 B를 소모하여 BH+ 0.012 0 mol을 만들어냄
- 표 작성하는 것을 추천

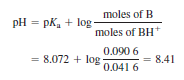
p. 225 자습 <완충 용액에 산을 첨가한 효과>
Q. HCl을 12.0 mL 대신 6.0 mL를 넣었을 때의 pH?

- 어느 정도 양의 강산이나 강염기를 첨가하더라도 완충 용액의 pH는 그다지 많이 변하지 않음
(위 예제에서 1.00 M HCl 12.0 mL를 첨가해서 pH가 8.61에서 8.41로 변함)
완충 용액이 pH의 변화를 막는 까닭?
- 강산이나 강염기가 B 또는 BH+에 의해 소모되기 때문
- 완충 용액은 pH = pKa일 때 pH 변화를 막는 용량이 최대가 됨
p. 225 예제 <완충 용액의 제조법 계산>
Q. 트리스 염화수소 10.0 g이 들어 있는 용액에 0.500 M NaOH 몇 mL를 첨가하면 최종 부피가 250 mL인 용액의 pH가 7.60이 되겠는가?
- 트리스 염과수소 10.0 g에 해당하는 몰수는 (10.0 g)/(157.596 g/mol) = 0.063 5 mol임

- pH와 pKa를 알고 있으므로 Henderson-Hasselbalch 식으로부터 x를 구함


- 이만큼의 NaOH가 들어 있는 부피는 다음과 같음
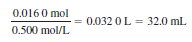
p. 226 자습 <완충 용액의 제조법 계산>
Q. 트리스 염화수소 10.0 g이 들어 있는 용액에 0.500 M NaOH를 몇 mL 첨가하면 최종 부피가 500 mL인 용액의 pH가 7.40이 되겠는가?

p. 225 질문
Q. 완충 용액을 만들기 위해 트리스 염화수소에 염기(NaOH)를 넣는 이유는 무엇인가?
: 트리스 염화수소는 약산 BH+이다. 완충 용액을 만들려면 BH+의 일부를 B로 바꾸어서 BH+와 B의 혼합물을 만들어야 한다.
p. 226 질문
Q. HEPES는 생화학에서 흔히 사용되는 pKa=7.56인 완충제다. HEPES로 완충 용액을 만들려면 NaOH와 HCl 중 어느 것을 첨가하겠는가?
: 중성 산 HA이다. HA와 A-의 혼합물을 만들기 위해서는 H+를 제거할 NaOH를 첨가해주어야 한다.
Keyword: 완충 용액(buffer), Henderson-Hasselbalch 식



