11-1. 강산에 의한 강염기의 적정
11-2. 강염기에 의한 약산의 적정
11-3. 강산에 의한 약염기의 적정
11-4. 이양성자성 계에서의 적정
11-5. pH 전극에 의한 종말점 검출
11-6. 지시약에 의한 종말점 검출
11-7. 실제적인 주의점
11-8. Kjeldahl 질소 분석법
11-9. 평준화 효과
11-10. 스프레드시트에 의한 적정 곡선의 계산
11-2. 강염기에 의한 약산의 적정
- 강염기에 의한 약산의 적정은 산-염기 화학의 모든 지식을 필요로 함
Q. 0.020 00 M MES 50.00 mL를 0.100 0 M NaOH로 적정하기?
- MES: 2-(N-모르포리노)에테인설폰산의 약자, pKa = 6.27인 약산
- 적정 반응(titration reaction)

- 위 반응은 염기 A-에 대한 Kb 반응의 역임
- 위 반응에 대한 평형 상수는 다음과 같음

- 평형 상수가 크므로, 가해지는 OH-에 따라 완결됨
(강염기와 약산의 반응은 완결됨)
- 당량점에 도달하는 데 필요한 염기의 부피 Vb 구하기

- 적정 계산은 네 가지 유형으로 생각
1> 염기가 가해지기 전, 물에는 HA만이 존재. 이 경우 약산의 문제가 되고, pH는 다음의 평형으로 결정됨

2> NaOH가 가해지기 시작하여 당량점에 도달하기 직전까지, A-와 미반응 HA의 혼합액으로 있음 (완충 용액)
→ 이때의 pH 계산은 Henderson-Hasselbalch 식 이용
3> 당량점에서 모든 HA가 A-로 변화됨
→ 물에 A-만을 녹인 것과 같은 용액이 만들어짐

4> 당량점 이후, 과량의 NaOH가 A- 용액에 가해짐.
- 이 용액의 pH는 강염기에 의해 결정되며, 좋은 근삿값 보여줌
- 단순히 과량의 NaOH가 물에 가해지는 것과 같이 pH 계산
(A-의 존재로 인해 나타나는 효과는 대단히 작으므로 무시)
영역 1: 염기를 가하기 이전
- 염기가 가해지기 이전에는 0.020 00 M HA 용액은 pKa = 6.27임 (단순한 약산의 문제)

영역 2: 당량점 이전
- 용액에 OH-가 가해지면, HA와 A-의 혼합액이 됨
- 이 혼합액은 완충 용액으로서, pH는 Henderson-Hasselbalch 식으로 계산
- 반응 전후의 상대적인 농도표

- pH 구하기
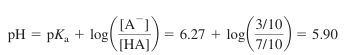
※ 적정 용액의 부피가 1/2 Ve가 되면, 산 HA에 대한 pH = pKa임
- 즉, Vb가 가해준 염기의 부피라고 할 때, 실험으로 얻는 적정 곡선으로부터 Vb = 1/2 Ve가 되는 점에서 읽은 pH 값으로 근사적인 pKa 값 구할 수있음

영역 3: 당량점에서
- 당량점에서 NaOH의 양 만큼 HA를 정확하게 소모할 수 있음

- 용액에는 A-만 남게 됨
- 증류수에 염 Na+A-를 녹이면, 이와 똑같은 용액이 만들어짐
- Na+A-의 용액은 단순한 약염기의 용액이 됨

- 한 가지 유의 점은, A-의 포말 농도는 HA의 초기 농도인 0.020 00 M이 아니라는 것
- A- 용액은 뷰렛으로 가해진 NaOH에 의해 이미 묽혀진 것임


- 이 적정에서 당량점에서의 pH = 9.25임. pH = 7.00이 아님!
- 약산의 적정에서는 당량점에서의 pH가 항상 7 이상인데, 이는 산의 당량점에서 그 짝염기로 바뀌기 때문
영역 4: 당량점 이후
- A- 용액에 NaOH를 하하게 됨
- NaOH는 A- 보다 강염기이므로 pH는 용액에 있는 과량의 OH- 농도에 의해서 결정됨
- Vb = 10.10 mL일 대 pH 계산 (Ve보다 0.10 mL 더 가해진 점)
- 과량의 OH- 농도

적정 곡선
- Vb = Ve일 때, 곡선은 가장 급경사를 이룸
- Vb = 1/2Ve일 때, pH = pKa이며, 기울기가 최소임
완충 용량(buffer capacity)
: pH의 변화를 저항할 수 있는 용액의 능력
- pH = pKa일 때
- pH의 변화에 대해 가장 저항력이 커지고, 기울기(dpH/dVb)는 최소


- HA의 산 해리 상수와반응물의 농도에 따라 적정 곡선이 어떻게 변화되는지 나타내고 있는 그래프
- HA가 약산일수록(높은 pKa)에서 또는 분석 물질과 적정액의 농도가 감소할수록 당량점 붑근에서의 급격한 굴절이 감소되며,
- 결국에는 너무 완만하여 당량점을 검출할 수 없게 됨
- 실제로 너무 약하거나 묽은 산이나 염기의 적정은 하지 않음
Keyword: 염기를 가하기 이전, 당량점 이전, 당량점에서, 당량점 이후



